江西省新建二中08―09学年高三上学期期中考试
化学试题
第Ⅰ卷(选择题 共48分)
一.选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
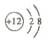 2.下列化学用语表示错误的是( )
2.下列化学用语表示错误的是( )
 A.镁离子结构示意图
A.镁离子结构示意图
B.氨分子结构

C.次氯酸电子式
D.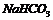 的电离方程式为:
的电离方程式为: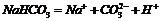
3.实验室中,有关试剂的保存方法错误的是
A.烧碱溶液保存在带玻璃塞的试剂瓶中 B.液溴用水封保存
C.少量金属钠保存在煤油中 D.氯水保存在棕色细口瓶中
4.下列实验不能达到预期目的的是
序号
实验内容
实验目的
A
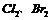 分别与
分别与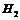 反应
反应
比较氯与溴的非金属性强弱
B
向饱和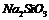 溶液中通入二氧化碳
溶液中通入二氧化碳
比较碳与硅的非金属性强弱
C
把碳酸钠与亚硫酸钠放置在空气中
比较碳与硫的还原性强弱
D
向氯化铜溶液中加入铁丝
比较铁与铜的还原性强弱
5.下列有关物质的结构或性质的叙述错误的是
A.由极性键形成的分子不一定是极性分子
B.水是一种非常稳定的化合物,这是由于氢键所致
C.石英.食盐.金属钠.干冰的熔点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
6.下列反应的离子方程式书写不正确的是
A.向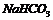 溶液中加入少量澄清的
溶液中加入少量澄清的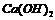 溶液:
溶液:
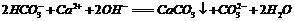
B.用碳酸钠溶液吸收少量二氧化硫: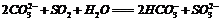
C.在饱和的苏打溶液里滴入少量盐酸: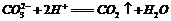
D.过量二氧化碳通入偏铝酸钠溶液中: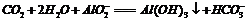
7.碘化砹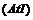 可发生下列反应:
可发生下列反应:
①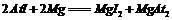 ②
②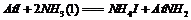
对上述两个反应的有关说法正确的是
A.这两个反应都是氧化还原反应
B.反应①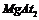 既是氧化产物,又是还原产物
既是氧化产物,又是还原产物
C.反应②中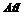 既是氧化剂,又是还原剂
既是氧化剂,又是还原剂
D.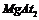 的还原性弱于
的还原性弱于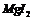 的还原性
的还原性
8.下表中,对陈述Ⅰ.Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项
陈述Ⅰ
陈述Ⅱ
A
氮气化学性质不活泼
氮原子最外层电子数为7
B
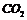 为直线型分子
为直线型分子
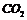 分子中
分子中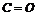 之间的夹角为
之间的夹角为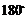
C
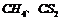 均为非极性分子
均为非极性分子
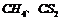 分子中只含极性共价键
分子中只含极性共价键
D
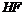 的沸点高于
的沸点高于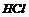
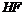 稳定性强于
稳定性强于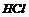 稳定性
稳定性
9.今有一混合物的水溶液,可能含有以下离子中的几种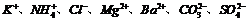 ,现分别取三份体积为100mL的该溶液进行如下实验:
,现分别取三份体积为100mL的该溶液进行如下实验:
第一份加入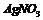 溶液有沉淀产生
溶液有沉淀产生
第二份加足量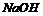 溶液加热后,收集到气体0.04mol
溶液加热后,收集到气体0.04mol
第三份加足量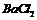 溶液后,得干燥沉淀
溶液后,得干燥沉淀
A.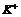 一定存在 B.
一定存在 B.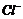 一定不存在
一定不存在
C.100mL溶液中含0.01mol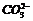 D.
D.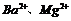 一定存在
一定存在
10.下列说法正确的是
①标准状况下,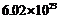
②标准状况下,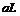 的氧气和氮气的混合物含有的分子数约为
的氧气和氮气的混合物含有的分子数约为 ③
③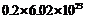
④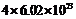
⑤1mol二氧化硅中含有的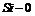 共价键数为
共价键数为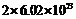
⑥500mL1mol/L的硫酸铝溶液中含有的硫酸根离子数约为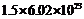
A.①④ B.②⑤ C.③⑤ D.②⑥
11.下列除杂方式中不合理的是
A.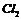 中混有
中混有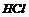 杂质,可以让混合气体通过饱和食盐水除去
杂质,可以让混合气体通过饱和食盐水除去
B.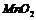 中混有的少量碘单质,可以用加热的方法除去
中混有的少量碘单质,可以用加热的方法除去
C.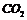 中混有
中混有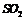 气体,可以通过饱和
气体,可以通过饱和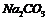 溶液除去
溶液除去
D.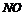 中混有
中混有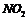 可通过水除去
可通过水除去
12.二氯化二硫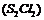 是广泛用于橡胶工业的硫化剂。常温下是一种橙黄色有恶臭的液体,它的分子结构与
是广泛用于橡胶工业的硫化剂。常温下是一种橙黄色有恶臭的液体,它的分子结构与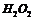 类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,
类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,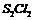 可由干燥氯气通入熔融的硫中制得,下列有关说法正确的是
可由干燥氯气通入熔融的硫中制得,下列有关说法正确的是
A.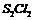 分子空间构型为正四面体形
分子空间构型为正四面体形
B.固态时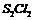 属于原子晶体
属于原子晶体
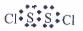 C.
C.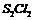 水解的化学方程式可能为:
水解的化学方程式可能为: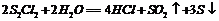
D.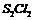 的电子式为
的电子式为
 13.某分子的球棍模型如右图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是
13.某分子的球棍模型如右图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是
A.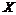 原子可能为ⅤA族元素
原子可能为ⅤA族元素
B.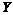 原子一定为ⅠA族元素
原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为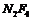
14.三氟化氮(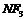 )是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: 则下列说法错误的是
则下列说法错误的是
A.反应过程中,被氧化与被还原的元素的物质的量之比为1 : 2
B.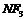 是一种无色.无臭的气体,因此
是一种无色.无臭的气体,因此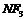 在空气中泄漏时不易被察觉
在空气中泄漏时不易被察觉
C.一旦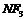 泄漏,可以用
泄漏,可以用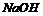 溶液喷淋的方法减少污染
溶液喷淋的方法减少污染
D.若反应中生成1.0mol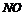 ,转移的电子数目为
,转移的电子数目为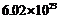
15.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
选项
操作及现象
溶液
A
通入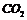 ,溶液变浑浊。继续通
,溶液变浑浊。继续通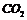 至过量,浑浊消失。再加入足量的
至过量,浑浊消失。再加入足量的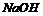 溶液,又变浑浊
溶液,又变浑浊
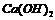 溶液
溶液
B
通入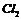 溶液变蓝色,再加入足量的
溶液变蓝色,再加入足量的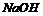 溶液,蓝色褪去,
溶液,蓝色褪去,
淀粉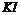 溶液
溶液
C
通入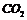 ,溶液变浑浊。再加入品红溶液,红色褪去
,溶液变浑浊。再加入品红溶液,红色褪去
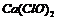 溶液
溶液
D
通入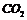 ,溶液变浑浊。继续通
,溶液变浑浊。继续通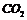 至过量,浑浊消失
至过量,浑浊消失
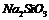
16.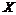 由
由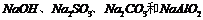 中的三种物质混合而成。取一定量
中的三种物质混合而成。取一定量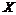 样品,投入100mL 2.4mol?L-1盐酸中,充分反应后,最终得到100mL含
样品,投入100mL 2.4mol?L-1盐酸中,充分反应后,最终得到100mL含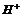 的物质的量浓度为1mol/L的溶液,若将此溶液蒸干.燃烧,得到
的物质的量浓度为1mol/L的溶液,若将此溶液蒸干.燃烧,得到
A.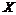 中一定含有
中一定含有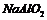 B.
B.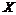 中一定不含有
中一定不含有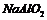
C.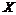 中一定不含
中一定不含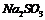 或
或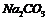 D.
D.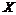 中一定不含
中一定不含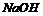
第Ⅱ卷(非选择题 共52分)
二.非选择题(包括6小题)
17.(8分)下列物质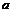 冰醋酸
冰醋酸 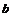 水晶
水晶  白磷
白磷 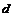 氯化氢
氯化氢 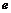 晶体氩
晶体氩 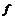 氢氧化钠
氢氧化钠 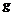 镁
镁
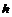 金刚石
金刚石 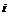 过氧化钠
过氧化钠 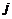 碳化硅
碳化硅 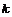 过氧化氢
过氧化氢 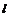 干冰
干冰
①属于原子晶体的化合物_________。 ②含非极性键的共价化合物____________。
③属于分子晶体的单质___________。 ④熔化时能导电的化合物______________。
18.(8分)某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在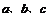 三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂.钠.钾块,观察现象。
三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂.钠.钾块,观察现象。
Ⅱ.乙同学设计实验验证:非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了下图装置:
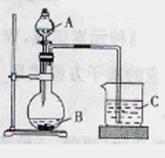
(1)甲同学设计实验的目的是_______________________,反应最剧烈的烧杯是_______(填序号)。
(2)乙同学设计的实验可证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状 固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
①写出所选用物质的化学式:
A_______,B______,C_________.
②写出烧杯中发生反应的离子方程式:____________________________。
19.(8分)现有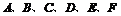 六种短周期元素,原子序数依次增大,已知
六种短周期元素,原子序数依次增大,已知 与
与 分别同主族,
分别同主族,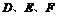 同周期;
同周期;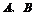 的最外层电子数之和与
的最外层电子数之和与 的最外层电子数相等,
的最外层电子数相等,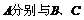 形成电子总数相等的分子甲和乙,且
形成电子总数相等的分子甲和乙,且 形成的化合物常温下均为液态,
形成的化合物常温下均为液态, 分别与
分别与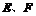 形成电子数相等的气体分子丙和丁。
形成电子数相等的气体分子丙和丁。
请回答下列问题:
(1)元素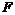 在周期表中位置________________。
在周期表中位置________________。
(2)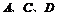 三种元素可组成一种常见化合物,该化合物的化学式为________________,生产该化合物和单质
三种元素可组成一种常见化合物,该化合物的化学式为________________,生产该化合物和单质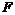 的的工业称为_____________工业。
的的工业称为_____________工业。
(3) 形成的化合物分子中,各原子达8电子结构,则该分子的电子式为___________。
形成的化合物分子中,各原子达8电子结构,则该分子的电子式为___________。
(4)已知0.5mol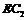 被
被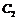 氧化成气态
氧化成气态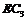 ,放出49.15KJ热量,其热化学方程式为____________。
,放出49.15KJ热量,其热化学方程式为____________。
(5) 以原子数比4 : 2 : 3所形成的化合物,晶体类型为_____________。
以原子数比4 : 2 : 3所形成的化合物,晶体类型为_____________。
20.(10分)有三种常见短周期元素 ,它们的原子序数依次增大。
,它们的原子序数依次增大。 元素原子最外层电子数比
元素原子最外层电子数比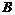 元素原子最外层电子数多1个,
元素原子最外层电子数多1个,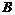 元素原子最外层电子数是
元素原子最外层电子数是 元素原子最外层电子数的一半。甲是
元素原子最外层电子数的一半。甲是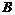 元素含氧酸的钠盐;乙是
元素含氧酸的钠盐;乙是 元素最高价含氧酸的酸式钠盐;丙是
元素最高价含氧酸的酸式钠盐;丙是 元素含氧酸的钠盐(正盐)。甲.丙溶液
元素含氧酸的钠盐(正盐)。甲.丙溶液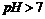 ,乙溶液
,乙溶液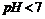 。丁为无色.无味的气体,戊为淡黄色固体,丁与戊的反应是呼吸面具中发生的主要反应。甲.乙.丙.丁.戊.已六种物质之间相互反应关系如下(与变化无关的产物已略去);
。丁为无色.无味的气体,戊为淡黄色固体,丁与戊的反应是呼吸面具中发生的主要反应。甲.乙.丙.丁.戊.已六种物质之间相互反应关系如下(与变化无关的产物已略去);
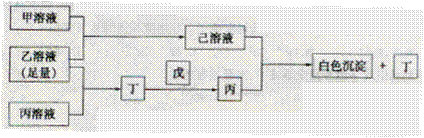
请回答:
(1) 元素的名称为___________;丁的结构式为____________;戊中化学键类型_____________。
元素的名称为___________;丁的结构式为____________;戊中化学键类型_____________。
(2)用电离方程式解释
乙溶液显酸性的原因是: ______________________________。
(3)写出有关反应的离子方程式: _________________。
①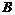 单质
单质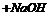 溶液: _______________。 ②已溶液
溶液: _______________。 ②已溶液 丙溶液
丙溶液 白色沉淀
白色沉淀 丁: __________________。
丁: __________________。
21.(12分)如图装置,浓盐酸与高锰酸钾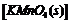 不加热就能产生气体单质
不加热就能产生气体单质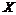 ,经过
,经过 两瓶,在
两瓶,在 处
处 与热的白色晶体反应,最后在
与热的白色晶体反应,最后在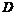 瓶内壁有紫黑色晶状物,请回答:
瓶内壁有紫黑色晶状物,请回答:
(1)写出该实验制 的化学反应方程式______________________________。
的化学反应方程式______________________________。
(2)制取气体 时,需要用到的玻璃仪器有:_____________.圆底烧瓶.导管。
时,需要用到的玻璃仪器有:_____________.圆底烧瓶.导管。
(3)通入 前,要得到纯净的气体
前,要得到纯净的气体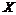 ,则
,则 瓶盛有________;
瓶盛有________;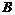 瓶盛有_________。
瓶盛有_________。
(4)若 处白色晶体的焰色反应为紫色,且只含有两种元素,则该白色晶体的化学式为________________;
处白色晶体的焰色反应为紫色,且只含有两种元素,则该白色晶体的化学式为________________;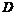 瓶内壁的紫黑色物质可用______________来洗涤。
瓶内壁的紫黑色物质可用______________来洗涤。
(5)在 处加热的目的是__________________________。
处加热的目的是__________________________。
(6)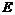 装置中盛有碱石灰,其作用是______________________。
装置中盛有碱石灰,其作用是______________________。
(7)该实验从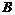 以后的装置存在的主要缺点是: _________________。
以后的装置存在的主要缺点是: _________________。
22.(6分)实验室制取氯气,将多余的氯气用100mL1.7mol?L-1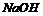 溶液完全吸收。对吸收后的溶液进行分析实验,测知:其
溶液完全吸收。对吸收后的溶液进行分析实验,测知:其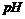 等于13(不考虑反应前后溶液的体积变化),
等于13(不考虑反应前后溶液的体积变化),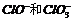 的物质的量浓度之比为5 : 1。请回答:
的物质的量浓度之比为5 : 1。请回答:
(1)吸收氯气消耗的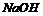 的物质的量为__________mol。
的物质的量为__________mol。
(2)被氧化的氯气的物质的量为__________mol,被还原的氯气的物质的量为___________mol。
(3)若将上述多余的氯气通入石灰乳中,理论上最多可制得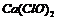 _________g。
_________g。
一.选择题(48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
A
C
B
C
B
B
题号
9
10
11
12
13
14
15
16
答案
A
D
C
C
B
B
D
A
二.非选择题(52分)
17.(1) .
. (2)
(2) .
. (3)
(3)
(4) (每空2分,答错或少答1个扣1分,扣到0分为止)
(每空2分,答错或少答1个扣1分,扣到0分为止)
18.(1)验证锂.钠.钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强)(2分);c(1分)
(2)① (各1分)
(各1分)
② (或
(或 (2分)
(2分)
19.(1)第三周期 ⅦA(1分)
(2) 氯碱(2分)
氯碱(2分)

(3)
(4) ;
; KJ/mol(2分)
KJ/mol(2分)
或 ;
; KJ/mol
KJ/mol
(5)离子晶体(1分)
20.(1)硫  离子键.非极性键(4分)
离子键.非极性键(4分)
(2) (2分)
(2分)
(3)① (2分)
(2分)
② (2分)
(2分)
21.(1)
(2)分液漏斗(1分)
(3)饱和食盐水(或饱和氯水)(1分)浓硫酸(1分)
(4) (1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(5)使生成的 升华,与其他固体分离(2分)
升华,与其他固体分离(2分)
(6)吸收多余的 ,防止污染空气(1分)
,防止污染空气(1分)
(7)连接 的导管易被
的导管易被 固体堵塞(2分)
固体堵塞(2分)
22.(1)0.16 (2)0.03 0.05 (3)5.72