2009届广东五校高三第三次联考试卷 化 学 (2008.12.05)
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分共10页,满分150分。考试时间120分钟。
2.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
3.回答第I卷时,把每小题所选答案用铅笔涂在答题卡相应位置。写在本试卷上无效。
4.回答第II卷时,将答案写在答题卷上。写在本试卷上无效。
可能用到的相对原子质量:
H:1 D:2 C:12 N:14 O:16 Cl:35.5 Na:23 Cu:64
第Ⅰ卷 选择题 (共63分)
一、选择题(本题包括9小题,每小题3分,共27分,每小题只有一个选项符合题意)
1.最近媒体报道了一些化学物质,如:爆炸力极强的N5、结构类似白磷的N4、比黄金还贵的18O2、太空中的甲醇气团等。下列说法正确的是
A.18O2和16O2是两种不同的核素
B.甲醇的分子式为:CH3OH
C.N4分子为正方形结构,每个分子中含有6个共价键
D.2N5= 5N2是化学变化
2.下列有关物质分类的说法中正确的是
A.石英玻璃、普通玻璃都属于硅酸盐产品
B.乙烯、乙醇都是纯净物
C.煤、石油都属于可再生能源
D.纯碱、烧碱都属于碱类物质
3.在c(H+)/c(OH-)=10?12的水溶液中,能大量共存的离子组是
A.K+、Al3+、Cl?、SO42? B.Ca2+、K+、CO32?、Cl?
C.Na+、K+、NO3?、CH3COO? D.Na+、Ba2+、I?、HCO3?
4.右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8。下列说法不正确的是
 A.Z的气态氢化物和Z的最高价氧化物的水化物的
A.Z的气态氢化物和Z的最高价氧化物的水化物的
浓溶液反应可生成单质Z
B.原子半径由大到小的顺序为:Z>W>X>Y
C.Y元素可形成多种氧化物
D.Z的氢化物比W的氢化物稳定
5.干燥剂的干燥性能可用干燥效率(
物 质
MgO
CaO
ZnCl2
ZnBr2
干燥效率 g/m3
0.008
0.2
0.8
1.1
分析以上数据,下列有关叙述不正确的是
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
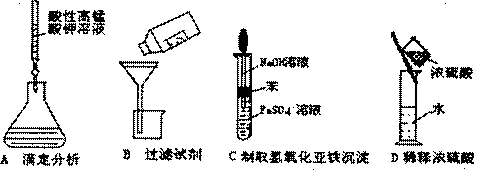
6.下列操作或仪器的选用正确的是
7.分析推理是化学学习方法之一。下列实验推理正确的是
A.灼热的铂丝与 NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
B.某雨水的pH小于5.6,说明雨水中一定溶解了SO2
C.某溶液中加入氯化钡溶液,生成白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42?
D.在溶液中可发生下列反应:I2+2HClO3= Cl2+2HIO3,说明I2的氧化性比Cl2强
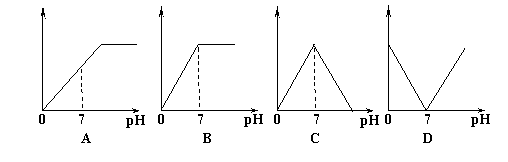
8.向盛有NaHSO4溶液的烧杯中不断滴入Ba(OH)2溶液,随着Ba(OH)2溶液的不断滴入,溶液中产生的沉淀量与pH变化情况正确的是
     |
9.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种有香味的酯,然后将这种酯水解,得到了乙酸和另一种化学式为C5H12O的物质。对于此过程,以下分析中不正确的是
A.化学式为C5H12O的分子中含有羟基
|
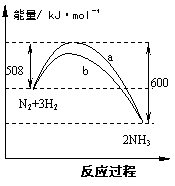 A.此反应N2+3H2
A.此反应N2+3H2  2NH3为放热反应
2NH3为放热反应 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是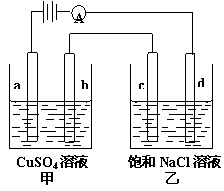 A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
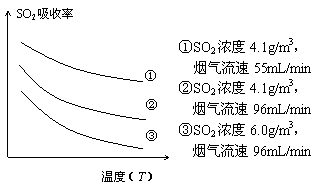 ②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。 FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示: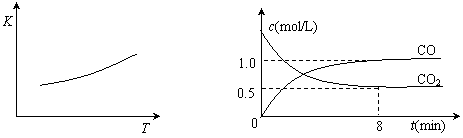

 Na2FeO4+3H2↑。
Na2FeO4+3H2↑。
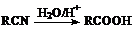 ; R―Br+NaOH→R―OH+NaBr
; R―Br+NaOH→R―OH+NaBr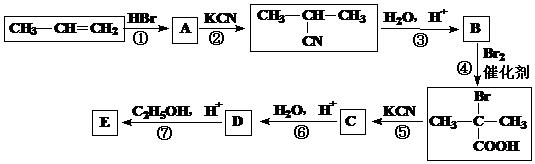 ⑴A的结构简式为:____________;
⑴A的结构简式为:____________;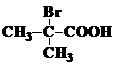 与足量NaOH溶液反应的化学方程式为____________________。
与足量NaOH溶液反应的化学方程式为____________________。 27、(10分)铜及其合金是人类最早使用的金属材料。
27、(10分)铜及其合金是人类最早使用的金属材料。 ③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2
 SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。 Mg+Cl2↑ ⑵Na2S
Mg+Cl2↑ ⑵Na2S HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
 ⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算) K2CO3+CO2↑+H2O(2分)
K2CO3+CO2↑+H2O(2分)
 (2分)
(2分) (2分)
(2分) (2分)
(2分)