山西省临汾一中、平遥中学、忻州一中2008-2009学年度高三第一次三校联考
化学试题(卷)
(考试时间90分钟,满分100分)
命题人: 张雅荣 李彦红 张永坚
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Cl-35.5 K-39 Zn-65 Ag-108 I-127
第I卷(选择题 共48分)
一、选择题(本大题共16小题,共48分。每小题只有一个选项符合题意,请将正确选项
1.北京奥运会 “水立方” 游泳池中的水主要是通过砂滤、臭氧和活性炭来净化的,下
列有关说法不正确的是
A.砂滤是利用过滤原理除去水中较大的固体颗粒
B.臭氧可以消毒杀菌是因为臭氧有强氧化性
C.活性炭可以吸附水中悬浮的杂质
D.游泳池水中的臭氧浓度越大越好
2.在pH=0的溶液中,下列各组离子因发生氧化还原反应而不能大量共存的是
A.K+、Na+、NO3-、Fe2+ B. K+、Na+、SO32-、Cl-
C.Ag+、Ca2+、Cl-、CO32- D. Na+、K+、Cl-、Br-
3. 已知1mol白磷转化为红磷时放出18.39kJ的热量,在下列两个反应中:
P4(白?s)+5O2(g)=2P2O5(s);ΔH=-akJ/mol(a>0)
4P(红?s)+5O2(g)=2P2O5(s);ΔH=-bkJ/mol(b>0) 则 a和b的关系是
A.a<b B.a=b C.a>b D.无法确定
4. 下列说法正确的是
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
5.H2、N2、O2三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强(P)
大小的关系,符合的是
A.P(H2)>P(O2)>P(N2) B.P(H2)>P(N2)>P(O2)
C.P(O2)>P(N2)>P(H2) D.P(N2)>P(O2)>P(H2)
6. 设NA为阿伏加德罗常数,下列说法正确的是
A.11.2LCO2所含的原子个数为1.5NA
B.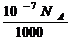
C.m g 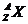
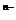 中所含电子总数为
中所含电子总数为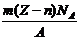
D.1mol十七烷分子中共价键总数为34NA
7.下列离子方程式书写正确的是
A.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH- = CaCO3↓+H2O
B.NaHSO4溶液中滴加少量Ba(OH)2溶液 H++SO42-+Ba2++OH- = BaSO4↓+H2O
C.FeBr2溶液中通入过量C12 2Fe2++6Br-+
D.FeC13溶液中通入足量H2S气体 Fe3++2H2S = FeS↓+S↓+4H+
8.某溶液中大量存在以下五种离子:NO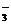 、SO42- 、Fe3+、H
、SO42- 、Fe3+、H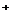 、M,其物质的量之比为:
、M,其物质的量之比为:
n(NO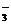 ):n(SO42-):n(Fe3+):n(H
):n(SO42-):n(Fe3+):n(H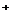 ):n(M)=2┱3┱1┱3┱1,则M可能是
):n(M)=2┱3┱1┱3┱1,则M可能是
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
9.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含
有共价键的离子型化合物
10.下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和 作出的推测是
 |
A.人体不能缺碘,需要正常补碘。“加碘食盐”中的“碘”是指碘单质
B. 该食盐商品是以海盐为原料,经人加工后的产品,是盐类的纯净物
C.
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
11.为达到预期的实验目的,下列操作正确的是
A.欲配制质量分数为10%的ZnSO4溶液,将l
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
12.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+
关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3 ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
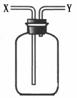 13.现有简易洗气瓶(如右图),正放在桌面上,可分别实现下列实验目的,其中适用于从y口进入的是:
13.现有简易洗气瓶(如右图),正放在桌面上,可分别实现下列实验目的,其中适用于从y口进入的是:
①瓶内盛一定量液体干燥剂,用于干燥气体
②瓶内盛一定量液体洗涤剂,用于除去气体中的某些杂质
③瓶内盛水,用于测量难溶于水的气体体积
④瓶内贮存难溶于水的气体,加入水使气体排出
⑤用于收集密度大于空气的气体
⑥用于收集密度小于空气的气体
A.①③ B.②④ C.③⑤ D.③⑥
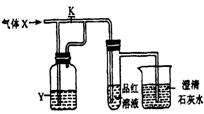 14.右图是一套检验气体性质的实验装置,向装置中缓缓地通入气体X,若关闭活塞K, 则品红溶液无变化,而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y可能是下表中的
14.右图是一套检验气体性质的实验装置,向装置中缓缓地通入气体X,若关闭活塞K, 则品红溶液无变化,而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y可能是下表中的
A
B
C
D
X
H2S
SO2
CO2
Cl2
Y
浓硫酸
NaHCO3
饱和溶液
Na2SO3
溶液
NaHSO3
饱和溶液
15. 在一定温度下,某无水盐R在水中溶解度为
A. 3(B-A)/
C. 23(B-A)/
16.一定量的锌与100 mL 18.5 mol?L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A
A.气体A为SO2和H2的混合物 B.气体A中SO2与H2的体积之比为4:
第II卷(非选择题 共52分)
17. (7分)请按要求填空:
(1)指出下列实验用品或仪器(已经洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质)______________;
②容量瓶____________。
(2当NaHCO3溶液中混有Na2CO3,为除去Na2CO3可以通入__________,化学
方程式为 。
(3)BaSO4中混有AgCl可通过加入 使AgCl转化为可溶的________除去。
18.(10分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之 和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个
电子。请回答下列问题:
(1)A和B两元素也可以形成18电子的化合物M,则M的电子式为 。
(2)由C和E所形成的化合物属于 晶体(填晶体类型)。
(3)由A、B、C、D四种元素所形成的两种化合物相互之间反应的离子方程式为:
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,将该盐溶液
在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,
则该过程的总反应方程式为 。
19.(14分)已知A―L所代表的物质(或溶液中的溶质)都是中学化学课本里学过的物质。通常状况下,A是淡黄色固体, B是金黄色固体,俗称”愚人金”,D是单质气体,E是无色无味气体,K是不溶于水的酸。反应①一③是化学工业生产某重要产品的三步反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如图所示(反应时加入或生成的水均没标出)
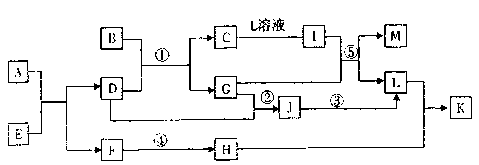
(1)写出下列物质的化学式:B ;D的同素异形体有
(2)写出A中含有的化学键类型 ;E的结构式
(3)反应①、②、③中属于放热反应的是 (填序号)
(4)完成下列反应方程式
反应⑤的离子方程式:
反应④的化学方程式:
(5)
20(12分)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧化物是否也可以作H2O2溶液分解的催化剂,请你参与他们的探究过程。
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂。
(2)[实验验证]:
实验步骤
实验现象
实验结论
实验一
将带火星的木条伸入装有过氧化氢溶液的试管中
木条不复燃
实验二
①
②
木条复燃
Al2O3能加快H2O2溶液的分解速率
(3)[结论]:故Al2O3能作H2O2溶液分解的催化剂。
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用。还应补充一个上述反应前后Al2O3质量是否改变的探究实验。
实验三:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行 、洗涤、干燥,然后④ 。
(5)有同学认为,即使实验三中Al2O3在反应前后质量不变,要证明猜想,上述三个实验还不足够证明,仍需要再增加一个探究Al2O3 的实验。
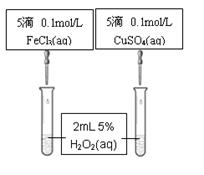 (6)另外化学兴趣小组为比较Fe3+和Cu2+对H2O2分解的催化
(6)另外化学兴趣小组为比较Fe3+和Cu2+对H2O2分解的催化
效果,该组同学设计了如图所示的实验。
可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
21.(9分) 现在由等物质的量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。
(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol?L―1。
(2)如果盐酸过量,生成CO2的体积为 L。
(3)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道
。
(4)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 。(要求写计算过程)
一、选择题(16×3分=48 分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
D
A
C
D
B
B
A
B
D
D
C
A
D
B
C
B
二、第II卷(非选择题 共52分)
17.(共7分,方程式2分,其余每空1分)
(1)①将石蕊试纸湿润 ②检验容量瓶是否漏水
(2)过量的CO2 CO2+Na CO
CO +H2O=2NaHCO3
+H2O=2NaHCO3
(3)氨水 Ag(NH3)2Cl
18.(10分,方程式3分,其余每空2分)
(1)H2O2的电子式 (2离子晶体
(3)HSO3― + H+ = SO2 ↑ + H2O
(4)2NaClO = 2NaCl + O2↑
19.(14分) (1)FeS2 (1分) O3和O2 (1分)
(2) 离子键 非极性共价键 (2分) O=C=O (1分)
(3)①②③ (3分)
(4)2Fe3++SO2十2H2O=SO42-十2Fe2++4H+ (2分)
Na2CO3+SiO2 Na2SiO3+CO2↑ (2分)
Na2SiO3+CO2↑ (2分)
(5) 0.2mol (2分)
20.(12分)实验一 在常温下H2O2分解少或不分解 (2分)
实验二 ①在实验一中加少量的Al2O3 (2分)
② 将带火星的木条置于试管口(2分)
(4) 过滤 (1分) 称量Al2O3的质量 (1分)
(5) 化学性质是否改变 (1分)
(6) 产生气泡速率快慢 (1分) 控制阴离子相同,排除干扰 (1分)
将FeCl3改为Fe2(SO4)3 (1分)
21.(9分) (1)
(3)盐酸的物质的量浓度 (2分)
(4) <
V(CO2)<
<
V(CO2)< (3分)
(3分)