绝密★启用前
2009年宣城市高三年级第三次调研测试
理科综合能力测试
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分300分,考试时间150分
钟。
2.答题前,考生务必将小答题卡和答题卷密封线内的项目填写清楚。
3.答第Ⅰ卷时,请将选出的答案,用2B铅笔规范的涂写在小答题卡上,不能笞在试题卷上。
4.考试结束,将小答题卡与答题卷交回。
以下数据可供解题时参考:
相对原子质量:H:1 O:16 Fe:56 S:32 Cu:64 Zn:
第Ⅰ卷(选择题 共120分)
一、选择题(本题共20小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.下列关于真核生物体内的化学反应,可不在细胞器中进行的是
A.信使RNA的合成 B.CO2的固定
C.胃蛋白酶的合成 D.丙酮酸的彻底氧化分解
2.前年,巢湖周边自来水供应系统因巢湖蓝藻大量繁殖造成的水污染而停水数日。下列关于蓝藻的叙述不正确的是
A.监藻属于生态系统中的生产者 B.蓝藻的遗传物质位于细胞核内
C.蓝藻没有线粒体也能进行有氧呼吸 D.基因突变可引起蓝藻发生变异
3.下图为家族性高胆固醇血症病因示意图。对这一图示的叙述错误的是
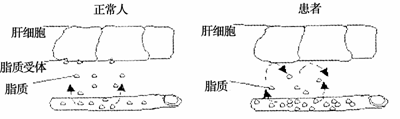
A.患者肝细胞中胆固醇水平很高
B.该病的的直接病因是患者肝细胞膜上的脂质受体有缺失
C.该病可能会引发血管硬化等心血管疾病
D.该病的根本原因是基因突变导致遗传信息发生了改变
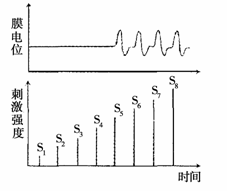 4.右图表示将刺激强度逐渐增加(S1~S8),一个神经细胞组织膜电位的变化规律,下列叙述正确的是
4.右图表示将刺激强度逐渐增加(S1~S8),一个神经细胞组织膜电位的变化规律,下列叙述正确的是
A.在S1~S4期间,细胞膜上没有离子的进出
B.在S5~S8时期,细胞膜的电位是外正内负
C.刺激要达到一定的强度才能诱导神经细胞产生 动作电位
D.刺激强度达到S5以后,随刺激强度增加动作电位逐渐增强
5.对植物群落的分层现象解释不正确的是
A.分层现象是植物群落对环境的一种适应
B.决定分层现象的环境因素除光照外,还有温度和湿度等
C.种植玉米时,因植物群落分层现象的存在,所以要合理密植
D.在农业生产上,可以充分利用分层现象,合理搭配种植的品种
6.噬菌斑(如下图甲)是在长满细菌的培养基上,由一个噬菌体侵染细菌后不断裂解细菌所产生的一个不长细菌的透明小圆区,它是检测噬菌体数量的重要方法之一。现利用连续取
样、在培养基中培养的方法测得T4噬菌体在感染大肠杆菌后数量变化曲线(如下图乙),据
图分析正确的是
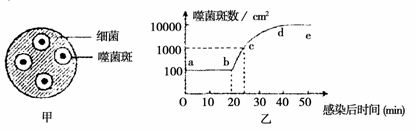
A.曲线a~b段细菌细胞中正旺盛地进行细菌DNA的复制和有关蛋白质的合成
B.曲线a~b段噬菌斑数量不变,说明此阶段噬菌体还没有开始侵染细菌
C.由b到c对应时间内噬菌体共繁殖了10代
D.限制c~d段噬菌斑数量增加的因素最可能是细菌绝大部分已经被裂解
7.生活中的许多现象可以用化学原理来解释,有关下列现象的解释中,不符合科学的是
A.“水滴石穿”的化学原理是溶解了CO2的雨水与CaCO3长期作用生成Ca(HCO3)2
B.铝制品在空气中不易被腐蚀是因为铝制品表面有一层致密的氧化膜
C.汽车排放的尾气中含有氮氧化物的主要原因是汽油燃烧小充分引起的
D.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于酸
8.常温下,下列各组离子在所给条件下能够大量共存的是
A.pH=0的溶液中:Fe3+、Mg2+、Cl―、SO42―
B.水电离出的c(H+)=1×10―10的溶液中:K+、HCO3―、Na+、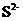
C.使pH试纸显深蓝色的溶液中:Cu2+、Fe3+、NO3―、SO42―
D.能与金属铝反应放出氢气的溶液:Mg2+、SO42―、NO3―、Na+
9.铝可与硝酸钠发生反应:Al+NaNO3+H2O→Al(OH)3↓+N2↑十NaAlO2(未配平),有关
叙述正确的是
A.该反应的氧化剂是水
B.若反应过程中转移5mole,则生成标准状况下N2的体积为
C.该反应的氧化产物是N2
D.当消耗1 molAl时,生成标准状况下N2的体积为
10.下列各溶液中,微粒的物质的量浓度关系不正确的是、
A.c(NH4+)相等的(NH4)2SO4溶液和(NH4)2CO3溶液 c[(NH4)2SO4]<[(NH4)2CO3]
B.0.1mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
C.0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合
c(Cl-)>c(Na+)>c(OH)>c(H+)
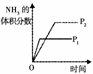
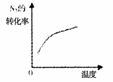
11.对于可逆反应N2(g)+3H2(g)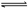 2NH3(g) △H<0,下列研究目的和示意图相符的是
2NH3(g) △H<0,下列研究目的和示意图相符的是
A
B
C
D
研究目的
压强对反应的
影响(P2<P1)
温度对反
应的影响
平衡体系增加N2对反应的影响
催化剂对反应的影响
图示
12.已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
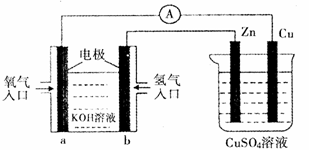
A. 该装置中Cu极为正极
B. 当铜极的质量变化为
C. 一段时间后锌片质量减少
D. B极反应的电极反应式为:H2-2e―=2H+
13.在一定温度下,氢氧化镁存在如下沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH―(aq)试推断氢氧化镁在下列物质中的溶解度最大的是
Mg2+(aq)+2OH―(aq)试推断氢氧化镁在下列物质中的溶解度最大的是
B.0.1mol?L―1KOH溶液
C.0.1mol?L―1KCl溶液
D.0.1mol?L―1NH4Cl溶液
14.在探索自然规律的进程中人们总结出了许多科学方法,如等效替代法、控制变量法、理想实验法等,在下列研究中,运用理想实验方法的是:
A.卡文迪许测定引力常量
B.牛顿发现万有引力定律
C.密立根测得电荷量e的数值
D.伽利略得出力不是维持物体运动原因的结论
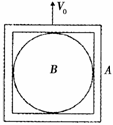 15.如图所示,小球B刚好放在真空器A内,将它们以初速度V0竖直向上抛出,下列说法中正确的是:
15.如图所示,小球B刚好放在真空器A内,将它们以初速度V0竖直向上抛出,下列说法中正确的是:
A.若不计空气阻力,上升过程中,B对A的压力向上;
B.若不计空气阻力,上升过程中,B对A的压力向下;
C.若考虑空气阻力,上升过程中,B对A的压力向上;
D.若考虑空气阻力,上升过程中,B对A的压力向下;
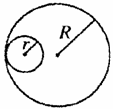 16如图所示,在垂直纸面的匀强磁场里有一个原来静止的放射性碳14,它所
16如图所示,在垂直纸面的匀强磁场里有一个原来静止的放射性碳14,它所
放射的粒子与反冲核的径迹是两个相切的圆,圆的直径比为7∶1,那么碳14的衰变方程是:
A.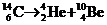 B.
B.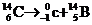
C. 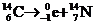 D.
D.
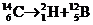
17.已知地球同步卫星的轨道半径约为地球半径的6.6倍,同步卫星的周期与地球的自转周期相同,根据你知道的常识,可以估算出地球的距离,这个距离最接近:
A.地球半径的40倍 B.地球半径的60倍
C.地球半径的80倍 D.地球半径的100倍
18.如图所示,电荷量为Q1、Q2的两个正点电荷分别置于A点和B点,
两点相距L,在以L为直径的光滑绝缘半圆环上,穿着一个带电小球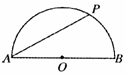
q(视为点电荷),在P点平衡,若不计小球的重力,那么PA与PB的
夹角α与Q1、Q2的关系满是:
A.tan2α=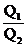 B.tan2α=
B.tan2α=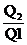
C.tan3α=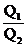 D.tan3α=
D.tan3α=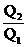
19.如图所示,两根足够长的平行金属导轨固定放置在同一水平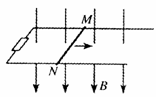
面上,其左端接一定值电阻,金属杆MN水平放在导轨上,且
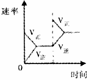
保持良好接触,金属杆具有一定的电阻,导轨电阻不计,整个
装置处于竖直向下的匀强磁场中。在外力作用下,金属杆从
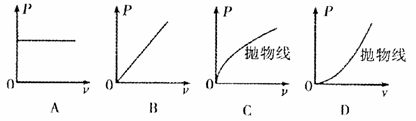
静止开始沿导轨水平向右加速运动,并始终与导轨垂直。下图中能正确反映金属杆克服安培力做功的功率P随金属杆速度变化规律的是:
20.如图所示,电源电动势为E,内阻为r,滑动变阻器电阻为R,开关闭合。两平行极板间有匀强磁场,一带正电粒子正好以速度v匀速穿过两板。以下说法正确的是: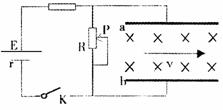
A.保持开关闭合,将滑片p向上滑动一点,粒子 将可能从下极板边缘射出;
B.保持开关闭合,将滑片p向下滑动一点,粒子将可能从下极板边缘射出;
C.保持开关闭合,将a极板向下移动一点,粒子将继续沿直线穿出;
D.如果将开关断开,粒子将继续沿直线穿出。
第Ⅱ卷(非选择题 共180分)
二、非选择题(本题共11小题,共180分)
21.(18分)(I)(8分)某探究学习小组的同学欲验证“动能定理”,他们在实验室组装了一套
如图所示的装置,另外他们还找到了打点计时器所用的学生电源、导线、复写纸、纸带、小
木块、细沙,当滑块连接上纸带,用细线通过渭轮挂上空的小沙桶时,释放小桶,滑块处于
静止状态,若你是小组中的一位成员,要完成该项实验,则:
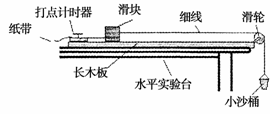
(1)你认为还需要的实验器材有 。
(2)实验时为了保证滑块受到的合力与沙和沙桶的总重力大小基本相等,沙和沙桶的总质
量应满足的实验条件是 ,实验时首先要做的步骤是
(3)在(2)的基础上,某同学用天平秤量滑块的质量M,往沙桶中装入适量的细沙,用天平秤出此时沙和沙桶的总质量m,让沙桶带动滑块加速运动,用打点计时器记录其运动
情况,在打点计时器打出的纸带上取两点,测出这两点的间距L以及这两点对应的滑
块速度大小v1与v2(v1<v2).则本实验最终要验证的数学表达式为
(用题中的字母表示).
(4)如果实验时所用滑块质量为M,沙及沙桶总质量为m,让沙桶带动滑块在水平气垫导
轨上加速运动,用打点计时器记录其运动情况,在打点计时器打出的纸带上取两点,测
出这两点的间距L和这两点的速度大小v1与v2(v1<v2),要探究滑块与沙及沙桶组
成的系统机械能是否守恒,则最终需验证的数学表达式为 (用题中的字母表示)。
(Ⅱ)(10分)某兴趣小组为了测量一待测电阻Rx的阻值,准备先用多用电表粗测出它的
阻值,然后再用伏安法精确地测量,实验室里准备了以下器材:
A.多用电表
B.电压表V1,量程6V,内阻约10kΩ
C.电流表V2,量程15V,内阻约20kΩ
D.电流表A1,量程
E.电流表A2,量程
F.电源:电动势E=6V
G.滑动变阻器R1,最大阻值10Ω,最大电流为
H.滑动变阻器R2,最大阻值50Ω,最大电流为
I.导线、电键若干
(1)在用多电表粗测电阻时,该兴趣小组首先选用“×
(2)按正确的操作程序再一次用多用电表测量该待测电阻的阻值时,其阻值如图乙中指针所示,则Rx的阻值大约是 Ω;
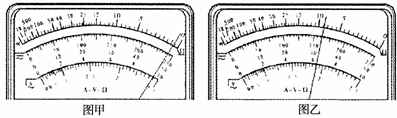
(3)在用伏安法测量该电阻的阻值时,要求待测电阻的电压从0开始可以连续调节,则在上述器材中应选出的器材是 (填器材前面的字母代号);
(4)在虚线框内画出用伏安法测量该电阻的阻值时的实验电路图.
22.(14分)一艘帆船在湖面上顺风行驶,在风力的推动下做速度,v1=
(1)有匀速行驶的状态下,帆船受到的动力为多大?
(2)空气的密度约为多少?
23.(16分)如图所示,一根不可伸长的轻绳跨过光滑的水平轴O,两端分别连接质量为m的小球A和质量为
(1)小球A由静止释放绕O点转过90°时,求小球的速度大小和物块对地面的压力
(2)若保持A的质量不变,将B换成质量也为m的物块,使绳OA水平,当小球A由静止释放转到O点正下方时,物块B的速度大小为v,求小球A的速度大小和方向(设A与B不会相碰,方向用三角函数表示)。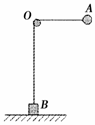
24.(20分)如图所示,竖直放置的正对平行金属板长L,板间距离也为L,两板间有场强为E的匀强电场(电场仅限于两板之间),右极板的下端刚好处在一有界匀强磁场的边界(虚线所示)上,该边界与水平成45°夹角,边界线以石有垂直纸面向里的匀强磁场。一质量为m、电量为e的电子在左侧金属板的中点从静止开始,在电场力作用下加速向右运动,穿过右极板中心小孔后,进入匀强磁场。
求:(1)从电子开始运动到进入匀强磁场所需的时间;
(2)匀强磁场的磁感应强度B应满足什么条件,才能保证电子从磁场出来后,还能穿越平行金属板间的电场区域。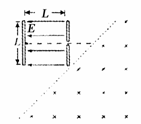
25.(15分)A、B、C、D、E、F六种短周期元素,原子序数依次增大,A和E同主族,A元素的原子半径最小,B元素形成的化合物目前在所有元素中种类最多,D元素原子的最外层电子数是内层电子数的3倍,A元素和F元素可形成共价化合物AF,其水溶液呈酸性。
请回答下列问题:(1)写出下列元素的名称:C ;F 。
(2)上述六种元素中,第一电离能量小的元素是 (元素符号),基态原子s轨道上所有电子数和p轨道上电子数相等的原子核外电子排布式为 。
(3)A单质和D单质可形成燃料电池提供电能,请写出碱性条件下的正极电极反应式:
。
(4)A元素和B元素可形成自然界最简单的有机物,常温常压下,
。
(5)A、C、F可形成离子化合物G,G的水溶液呈弱酸性,请写出G的水溶液中各离子浓度由大到小的顺序: 。
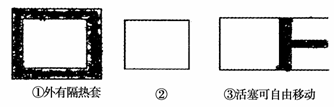
(6)如图所示,三个容积相同的容器①②③,若起始温度相同,分别向三个容器中充入3molA2和1molC2;一定条件下反应,达到平衡时各容器中CA3的百分含量由大到小的顺序为 。(已知该反应△H<0)
26.(11分)以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
某工厂运用该原理生产铜和绿矾(FeSO4?7H2O)的工艺如下:
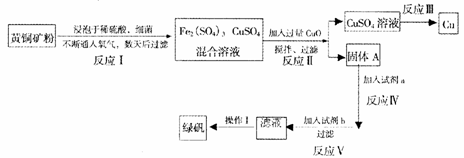
回答下列问题:
(1)固体A的成分为) (写化学式);
(2)写出反应Ⅲ的化学方程式 ;
(3)试剂a为 ,试剂b为 ;
(4)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为 、 、 。
(5)反应Ⅱ中CuO的作用是 。
27.(16分)某化学兴趣小组在按图1装置做金属钠在空气中燃烧的实验时,观察到产物不仅仅有淡黄色的固体生成,还有少量的黑色颗粒产生,该小组对黑色颗粒进行了如下探究:
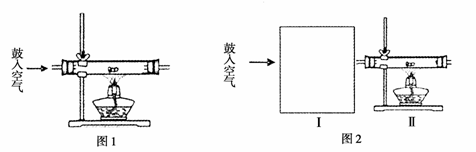
(1) 甲同学查阅资料知:
4Na+3CO2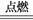 2Na2CO3+C;
2Na2CO3+C;
据此推测黑色颗粒是 。
(2)乙同学认为只要将上述实验稍做改进,即可证明同学的猜想是否合理,请在图
的Ⅰ中画出装置图并注明相关药品的名称。
(3)丙同学按照乙同学的实验方案进行实验后,仍然发现微量的黑色固体,于是认为可能是金属钠含有其他杂质,他发现在保存钠的试剂瓶的标签上有如下内容:
元素符号:Na 纯 度:89% 相对原子量:22.99
杂质含量:氯化物(Cl)――0.003% 氮――0.002%
磷酸盐――0.001% 硫酸盐――0.002% 铁――0.002%
结合以上信息,丙同学认为微量黑色固体是铁的氧化物,请设计一简单实验证明丙的结论:
实验步骤
实验现象及结论
①收集上述微量黑色固体于试管中,
②
(4)结合以上三位同学的实验研究,你认为图1实验中的黑色颗粒组成为 。(填名称)
28.(16分)A―H均为链状有机物,它们之间有如下转化关系:
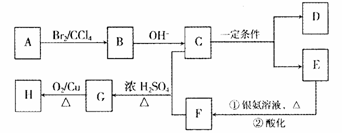
其中A、D常温下为气态,C的相对分子质量为90,C和乙二醇互为同系物,H能发生银镜反应。已知:
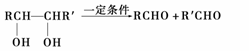
(R、R′可以是烃基也可以是氢原子)
(1)D的化学名称是 ;C的分子式是 ;
(2)C不能发生的反应是 (填字母)。
a.氧化反应 b.消去反应 c.酯化反应 d.加成反应
(3)H的结构简式是 :
(4)写出下列反应的化学方程式:
E和银氨溶液共热的反应: 。
C和F在浓硫酸作用下生成G的反应: 。
(5)F的同分异构体中含有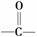 的异构体共有个
(不包含F),任写其中
的异构体共有个
(不包含F),任写其中
种 。
29.(19分)玉米是高产的主要粮食作物,为了提高玉米的产量,在农业生产中玉米使用的都是杂交种,杂交玉米的性状不稳定遗传,因此农民每年都需要购买玉米杂交种。请回答下列有关问题。
(1)农学家发现,尽管土壤中各种矿质养料充足,但玉米若长时间生长在多雾的阴湿天气或者土壤板结的环境中,植株上部叶片都会表现出一定程度的矿质元素缺乏症。试分析造成缺乏症的原因分别是:
前者: 。
后者: 。
(2)玉米从种子发芽到新种子成熟,整个过程需90~150天,玉米是一种雌雄同株的植物,其顶部开雄花,下部开雌花,是遗传学研究的良好材料。其理由包括(写出两条)
第一 ;
第二 。
(3)玉米粒胚乳的外层叫做糊粉层,其颜色与细胞中的色素有关,当细胞中含有甲物质时呈紫色,含有乙物质时呈红色,无甲和乙时呈白色,与这些色素合成有关的部分酶和基因情况如图所示(注:各对等位基因中的显性基因对隐性基因完全显性,隐性基因不能控制相应酶的合成。)
色素
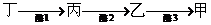
酶
酶1
酶2
酶3
控制酶合成的基因
A
B
D
相应的等位基因
a
b
D
基因所在的染色体
9号
10号
5号
①糊粉层为红色的子粒长成的某一玉米植株自交,若所结子粒的性状分离比为紫∶红∶白=0∶3∶1,则该植株的基因型为 。
②糊粉层为紫色的子粒长成的某一玉米植株自交,若所结子粒的性状分离比为紫∶红∶白=9∶3∶4,则该植株的基因型为 。
(4)现有长果穗(A)白粒(b)和短果穗(a)黄粒(B)两个玉米杂合子品种,为了达到长期培育长果穗黄粒(AbBb)杂交种玉米的目的,请你以遗传图解并简要说明的形式,设计出你的育种方案。
30.(9分)豇豆对多种害虫具有抗虫能力,根本原因是豇豆体内具有胰蛋白酶抑制剂基因(CPTI基因)。科学家将其转移到水稻体内后,却发现效果不佳,主要原因是CPTI蛋白质的积累量不足。经过在体外对CPTI基因进行了修饰后,CPTI蛋白质在水稻中的积累量就得到了提高。修饰和表达过程如下图所示:
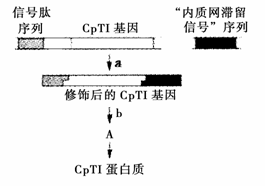
(1)CPTI基因是该基因工程的 基因,“信号肽”序列及“内质网滞留信号”序列的基本单位是 ,在①过程中,首先要用 酶切出所需基因并暴露出 ,再用 连接。
(2)在该基因工程中,供体细胞是 ,受体细胞是 。
(3)b过程称为 。
(4)检测修饰后的CPTI基因是否表达的最好方法是 。
31.(26分)下图甲表示春季晴天某密闭大棚内一昼夜CO2浓度的变化。乙图曲线a表示某种植物在
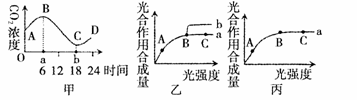
(1)甲图中,一昼夜中CO2浓度最高和最低的时间点分别是a时和b时,a时间点的含义是 ,b点时间点的含义是 。
(2)分析乙图在B点时改变的某种条件可能是(列举两种情况):
可能①: 。
理由: 。
可能②: 。
理由: 。
(3)乙图中A点与B点相比较,A点时叶绿体中C3的含量 (填“多”或“少”),NADPH的含量 (填“多”或“少”)。
(4)乙图如果在A、C点时温度分别降低
(5)恩格尔曼研究光合作用时选择水绵作为研究材料的优点是 ,好氧细菌的作用是 ,将水绵和好氧细菌制成临时装片,为排除外界环境的干扰,必须放在 环境里。
生物参考答案及评分标准
1―
29.(19分)
(1)蒸腾作用弱,影响矿质元素的运输(2分)土壤中缺氧导致根细胞呼吸作用弱,产生能量少,
影响根对矿质离子的主动运输。(2分)
(2)第一:生长期短,繁殖速度快;第二:产生的子代多,统计更准确;第三:具有容易区分的相对性状。(任选两项,其他合理答案也可)(4分)
(3)①AABbdd或AaBBdd(2分)②AABbDd(2分)
(4)(方案一或方案二或方案三,其他合理方案也可,确定亲本的基因型得2分。)(7分)
方案一:

30.(9分,每空1分)①目的 脱氧核苷酸 限制性内切 黏性末端 DNA连接酶
②豇豆细胞 水稻细胞
③转录
④让多种害虫食用水稻叶片
31.(26分)[每空2分(4)图4分]
(1)a点:表示光合作用强度等于细胞呼吸的强度
b点:表示光合作用强度等于细胞呼吸的强度
(2)①温度适当增加理由:在一定的温度范围内,随着温度的增加光合作用增强
②CO2的浓度增加理由:在一定的CO2浓度范围内,随着CO2浓度的增加光合作用增强
(3)多 少
 (4)
(4)
(5)叶绿体呈螺旋式带状分布,且大而明显便于观察,确定释放氧气多的部位,没有空气的黑暗
化学参考答案及评分标准
7―13:C A B D C B D
25.(1)氮、氯(2分)
(2)Na(1分); 1s22s22p4(2分)
(3)O2+2H2O+4e―=4OH―(2分)
(4)CH4(g)+2O2(g) CO2(g)+2H2O(1) H=-889.6kJ?mol―1(3分)
CO2(g)+2H2O(1) H=-889.6kJ?mol―1(3分)
(5)c(Cl-)>c(NH4+)>c(H+)>c(OH―)(2分)
(6)③>②>①(3分)
26.(1)Fe(OH)3、CuO(2分) (2)CuSO4+Fe=Cu+FeSO4(2分)
(3)稀H2SO4,铁粉(2分) (4)蒸发浓缩,冷却结晶、过滤(3分)
(5)调节混合溶液的pH,使Fe3+完全沉淀。(2分)
27.(1)钠与空气中的二氧化碳反应生成的炭黑(2分)
(2)装置2分,试剂2分,碱石灰也可用U形管装,其他合理答案也可。

(3)(每空2分,共8分,其他合理答案也可)
实验步骤
实验现象及结论
①收集上述微量黑色固体于试管中,
滴加过量的稀硫酸
②取少量反应后的溶液于试管中,滴加KSCN溶液
固体全部溶解,说明不是炭黑
溶液变为红色,说明是铁的氧化物
(4)炭黑和铁的氧化物(2分)
28.(1)甲醛(2分) C4H10O2(2分) (2)d(2分)
(3)CH3CH2CH(OOCCH2CH3)CHO(2分)(写成―COH、CHO―、O―OC,0分)
(4)CH3CH2CHO+2Ag(NH3)2OH CH3CH2COONH4+2Ag↓+3NH3+H2O(2分)
CH3CH2COONH4+2Ag↓+3NH3+H2O(2分)
CH3CH2COOH+CH3CH2CH(OH)CH2OH CH3CH2CH(OOCCH2CH3)CH2OH+H2O(2分)
CH3CH2CH(OOCCH2CH3)CH2OH+H2O(2分)
(5)6种(2分) 写出以下6种中任一即可得2分:HCOOCH2CH3、CH3CH(OH)CHO、
CH3OCH2CHO、HOCH2CH2CHO、CH3COOCH3、CH3COCH2OH;
物理参考答案及评分标准
14.D 15.C 16.C 17.B 18.D 19.D 20.B
21.(Ⅰ)(8分)(1)天平,刻度尺(2分)
(2)沙和沙桶的总质量远小于滑块的质量(1分),平衡摩擦力 (1分)
(3)mgL= (2分)
(2分)
(4)mgL= (2分)
(2分)
(Ⅱ)(10分)(1)“×1”欧姆挡 (2分)
(2)9Ω (2分)
(3)BDFGI (2分)
(4)如图所示 (4分)
22.(14分)解:(1)风突然停止后,船体在阻力f的作用下做匀减速运动船体加速度大小:a=△v/△t=4/8=
∴船体只受阻力:f=Ma=940×0.5=470N (2分)
帆船在匀速运动时受到风的推力和水的阻力而平衡,所以:
帆船受到风的推力大小:F=f=470N (2分)
(2)(说明:没有相应的估算过程,直接写出空气密度的不能得分)
在单位时间内,对吹入帆面的空气(柱)应用动量定量有:
Ft=Δm?Δv=ρSΔvt?Δv (4分)
Δv=v2-v1=10-4=
23.(16分)解:(1)对A球,OA转过90°的过程,设小球A在O点正下方时的速度为v0,由机械能守恒得 mgL=
解得 v0= (2分)
(2分)
A在O点正下方时,设绳对小球A的拉力为T,地面对物块的支持力为NB
对小球A有 T-mg=m
解得 T=3mg (2分)
绳对物块B的拉力T′=T=3mg
对物块B  解得
解得
NB=mBg-T′=4mg-3mg=mg (2分)
由牛顿第三定律可知,物块B对地面的压力大小
N′B=NB=mg 方向竖直向下 (2分)
(2)设小球A在O点正下方时的速度大小为vA,与水平向左方向成θ角斜向下,对小球A和物块B组成的系统,由机械能守恒有
mgL= (3分)
(3分)
解得 vA= (1分)
(1分)
小球A在O点正下方时速度的竖直分量 vAy=V (2分)
 速度分解如图所示
速度分解如图所示
速度方向与水平向右夹角θ的正弦值
sinθ= (2分)
(2分)
24.(20分)解(1)电子在电场中做匀加速运动,设离开电场时速度为v,所用时间为t1,根据牛顿第二定律及运动学公式得:
a= (2分)
(2分)
L= (2分)
(2分)
v=at1 (1分)
电子从离开电场到进入磁场做匀速直线运动,所用时间为t2,则 (1分)
(1分)
设从电子开始运动到进入云强磁场所需的时间为t,则
t=t1+t2= (3分)
(3分)
(2)电子在磁场中做圆周运动,x经3/4周从磁场出来时,速度应沿竖直方向,在电场中做类平抛运动。设电子穿越电场所需时间为t3,偏转距离为x,则L=vt3 (2分)
x= (2分)
(2分)
为保证电子从磁场出来后能进入电场并能从电场中出来,电子在磁场中运动的半径R应满足
 (2分)
(2分)
电子在磁场中运动轨道半径:R= (2分)
(2分)
由以上公式可得: (3分)
(3分)