2009-2010学年度招远市第一学期初四第一学段测评
化学试卷
说明:本试题满分100分,考试时间90分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Ca:40
C1:35.5 Fe:56 Ag:108
第Ⅰ卷(选择题部分,共30分)
一、选择题(本题包括10个小题,每小题1分,共10分。每小题只有一个选项符合题意)
1.下列关于物质用途的描述不正确的是
A.食盐可用作调味品 B.盐酸可用于金属除锈
C.干冰可用于人工降雨 D.熟石灰可用于改造碱性土壤
2.下列关于海水晒盐原理的分析,正确的是
A.利用阳光照射使海水升温得到食盐
B.利用机械动力搅拌得到食盐
C.利用阳光和风力将水分蒸发得到食盐
D.利用海水在阳光下发生分解反应制得食盐
3.长期使用的热水瓶胆内部常附有一层水垢(主要成分是CaCO3),除去水垢的有效方法是
A.用洗洁精洗涤 B.用食盐水洗涤
C.用食用白醋洗涤 D.用肥皂水洗涤
4.下列溶液的pH最小的是
A.使石蕊试液显蓝色的溶液 B.使石蕊试液显红色的溶液
C.使石蕊试液显紫色的溶液 D.使酚酞试液显红色的溶液
5.下列说法不正确的是
A.石蕊试液是一种酸碱指示剂 B.酸溶液能使红色石蕊试纸变蓝
C.酸溶液中都含有氢离子 D.碱溶液中都含有氢氧根离子
6.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下,则下列说法中,正确的是

(说明:一种小球代表一种元素的原子)
A.图中的反应物都是化合物 B.该反应属于化合反应
C.该反应属于复分解反应 D.该反应符合质量守恒定律
7.学校研究性学习小组选择探究“CuSO4溶液显蓝色与什么离子有关?”作为研究课题,以下是他们提交的实验方案,其中不需要做的实验是
A.观察Na2SO4、K2SO4溶液的颜色
B.观察CuCl2、Cu(NO3)2溶液的颜色
C.加水稀释后观察溶液的颜色
D.向CuSO4溶液中滴加适量的NaOH溶液,静置后观察溶液的颜色
8.对分离与提纯海水流程的有关认识错误的是
A.可用降低温度的方法从海水中获得粗盐
B.粗盐提纯为较纯净食盐晶体的操作为:溶解、过滤、蒸发
C.通常在卤水中加入熟石灰制取氢氧化镁
D.海水中的食盐用途广泛,例如侯德榜利用食盐为原料制得了纯碱
9.室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出。对于该溶液,下列说法正确的是
A.溶质的溶解度减小 B.溶质的质量减小
C.溶质的质量分数减小 D.溶液变成不饱和溶液
10.下列说法正确的是
A.与盐酸反应放出气体的物质一定是碳酸盐
B.生成盐和水的反应不一定是酸与碱的反应
C.有发光、放热现象的就是燃烧
D.能使石蕊试液变蓝的溶液都是碱溶液
二、选择题(本题包括10个小题,每小题2分,共20分。每小题有1个或2个选项符合题意,多选、错选均不得分,漏选扣1分)。
11.小英的妈妈在洗碗筷时,经常在水中加入一种物质,很快就能将“油乎乎”的菜盘洗得干干净净。小英的妈妈在水中加入的物质可能是
A.烧碱 B.洗洁精 C.纯碱 D.汽油
12.下面对涉及“侯氏制碱法”有关知识的说法不正确的是
A.该条件下NaHCO3的溶解度较小
B.析出固体后的溶液为NaHCO3饱和溶液
C.NaHCO3是纯碱
D.从该反应中能获得氮肥
13.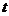 ℃时,向一支盛有
℃时,向一支盛有
A.溶液为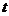 ℃时的饱和溶液 B.升高温度溶液变为不饱和溶液
℃时的饱和溶液 B.升高温度溶液变为不饱和溶液
C.溶液中溶质的质量等于
14.在“重结晶法提纯粗盐”的实验中,用蒸发皿蒸发滤液时,下列操作正确的是
A.把浑浊的滤液倒入蒸发皿里,进行加热
B.等到开始出现固体时,用玻璃棒不断搅拌液体
C.等到出现多量固体时,停止加热
D.待滤液完全蒸干后,停止加热
15.下列关于溶液的说法错误的是
A.饱和溶液析出晶体后,其溶质的质量分数一定变小
B.在溶液里进行的化学反应,通常比较快
C.同种溶质的饱和溶液,一定比同温度下它的不饱和溶液的溶质质量分数大
D.不饱和溶液转化为饱和溶液,溶质质量分数可能不变
16.图表资料可以为我们提供很多信息,下列关于图表提供的资料或应用的说法中,不正确的是
A.根据酸、碱、盐的溶解性表,可判断酸、碱、盐的溶解性
B.根据溶解度曲线图,可选择从溶液中获得晶体的方法
C.根据元素周期表,可查找元素在地壳中的含量
D.根据空气质量周报,可知道空气质量级别和首要污染物
17.常温下,在两只各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如下图所示。下列说法正确是

A.甲溶液是饱和溶液
B.常温下,甲、乙两种物质的溶解度相同
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能达到饱和,也可能未达饱和
18.向一定量的饱和氢氧化钠溶液中,加入少量的氧化钠(氧化钠与水反应生成氢氧化钠),恢复到原来的温度时,下列说法不正确的是
A.溶液中 的总数不变 B.单位体积内的
的总数不变 B.单位体积内的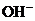 数目不变
数目不变
C.溶液溶质质量分数不变 D.溶液质量不变
19.下图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是
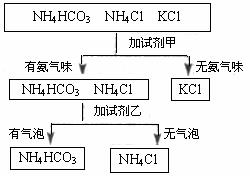
A.甲:熟石灰; 乙:稀盐酸 B.甲:水; 乙:氢氧化钠溶液
C.甲:氢氧化钠溶液; 乙:稀硫酸 D.甲:稀盐酸; 乙:氯化钠溶液
20.甲、乙两工厂的生产污水中各含有下列五种离子中的三种(两厂含有一种相同的离子):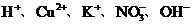 。若两厂单独排放都会造成严重的污染。若将两厂的污水按一定比例混合,沉淀后污水会变成只含一种溶质的无色澄清溶液,此溶质可做化肥。下列关于污水的分析,不正确的是
。若两厂单独排放都会造成严重的污染。若将两厂的污水按一定比例混合,沉淀后污水会变成只含一种溶质的无色澄清溶液,此溶质可做化肥。下列关于污水的分析,不正确的是
A.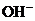 和
和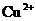 来自同一工厂 B.
来自同一工厂 B.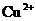 和
和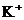 来自同一工厂
来自同一工厂
C.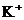 和
和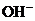 来自同一工厂 D.
来自同一工厂 D.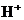 和
和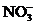 来自同一工厂
来自同一工厂
第Ⅱ卷 非选择题部分(70分)
三、填空题(本题共包括4个小题,(除标注外)每空1分,共30分)
21.(7分)通过化学学习,我们认识了“酸”和“碱”,请回答下列问题:
(1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在有相同的___________离子(填符号),因此,它们有很多相似的化学性质,如:__________________等(写二条即可,每条1分)。
(2)碱有氧氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥________等气体。生石灰也可作干燥剂,其干燥的原理可用化学方程式表示为:_________ ___________________________。
(3)酸和碱的中和反应在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为:________________。
(4)人被蚊虫咬后皮肤会红肿痛痒,这是由于蚊虫在被叮咬的皮肤内注入了少量的酸性物质所致。在被咬的皮肤上涂少许下列生活用品中的_________(填序号),痛痒便会消失。
A.香油 B.肥皂水 C.纯碱水 D.糖水
22.(3分)试管中盛有固体物质A,向试管中加入一种液体物质B后,观察到有气泡产生。请你依据上述实验现象,对A和B的组合至少做出三种猜想(要求三种组合中的固体A分别属于不同类别的物质):______________________;______________________;______________________。
23.(10分)味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠。谷氨酸钠有鲜味,易溶于水。小倩发现某品牌味精包装上标注:谷氨酸钠≥80%,氯化钠含量≤20%。她想测定味精中氯化钠的含量(提示: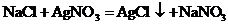 ,谷氨酸钠的存在不影响氯化钠的性质)。
,谷氨酸钠的存在不影响氯化钠的性质)。
(1)下面是她所做实验有关步骤,请补全实验步骤:①称取该味精样品
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的玻璃仪器除烧杯、漏斗外,还需要_________。
②检验沉淀是否洗净的方法____________________________________。(2分)
③此样品中氯化钠的质量分数为_________(2分)。是否符合其包装上标注的标准?____________________________________。
(3)味精的鲜味与溶液的酸碱度有关,当pH为6到7时鲜味最强。味精的鲜味还与温度有关,其水溶液在
24.(10分)烟台是美丽的海滨城市,有较长的海岸线,海洋资源十分丰富。以下是我市对海水资源的部分利用。
(1)海水中含量最高的盐是_________,海水经_________结晶可获得粗盐。
(2)粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后再进行如下操作即可得到较纯的氯化钠:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑥加过量的BaCl2溶液。正确的操作顺序是_________。(2分)
(3)从晒盐后的卤水中提取重要金属镁。提取镁的步骤如下:
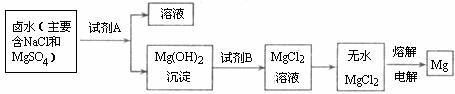
提取Mg的过程中,试剂A最好选用_________(从我市有丰富的石灰石资源考虑),试剂B选用____________。电解无水MgCl2的过程中___________能转化为____________能。
(4)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱。写出上述反应的化学方程式:
①______________________________________________________;
②______________________________________________________。
四、简答题(本题包括2个小题,(除标注外)每空1分,共12分)
25.(6分)下图是常见酸、碱、盐之间的相互转化关系。
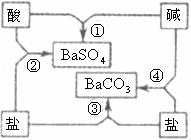
(1)写出图中相应物质的化学式:酸___________、碱___________。
(2)写出图中反应②和④的化学方程式:
②_______________________________________________________
④_______________________________________________________
(3)总结化学反应的规律是我们学习化学的方法之一。请根据上图总结出酸、碱、盐相互反应的规律(写2点)______________________、______________________。
26.(6分)下图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
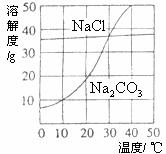
(1)当温度为
(2)当温度___________时,氯化钠的溶解度大于碳酸钠的溶解度;
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。请你解释原因:“夏天晒盐” _______________________;(2分)“冬天捞碱” ____________________。(2分)
五、实验探究题(本题包括2个小题,每空1分,共16分)
27.(8分)某化学兴趣活动小组的同学想探究某温度下氯化钠溶液的酸碱度,过程如下:
【猜想与假设】溶液的pH可能为①pH<7;②___________;③___________。
【设计与实验】要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的___________(填序号)来进行实验。
①pH试纸 ②紫色石蕊试液 ③酚酞试液
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡片比较,测得pH=7
乙同学:pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡片比较,测得pH=7
丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡片比较,测得pH=7
【评价与反思】三位同学中操作正确的是___________,指出其他同学的操作错误:__________________________________________。
【结论与分析】丙同学得出“凡是盐溶液的pH都等于
28.(8分)小明在做某次实验时,发现一瓶瓶口已敞开不知多久的氢氧化钠溶液(下称试液)。联想到药品保存注意事项,小明利用提供的试剂(CaCl2溶液、盐酸、CaCO3固体、酚酞)对试液是否变质展开了探究。
他首先猜想的是:试液没有变质,溶液的溶质还是NaOH,根据实验方案进行的实验:
①取少量试液加入试管,滴入酚酞,观察到试液变红。由此得出结论是原试液没有变质,还是NaOH。
②小明反思实验验证,觉得不够完善,理由是_________________________________。
③完善实验方案后他从提供的试剂中选取一种试剂进行实验。发现原试液确已变质。请你写出他这次实验的操作:____________________,现象是:____________________。小明是个爱思考的学生,他又有一个新的疑问:试液中真的没有NaOH了吗?他又做了进一步探究:
④猜想_______________________________________________________。
⑤实验验证:实验操作_________________________________;实验现象____________ ______________________,实验结论_________________________________。
⑥通过探究,小明明白了:氢氧化钠溶液暴露在空气中会变质,故应___________保存。
六、计算题(本题包括2个小题,共12分)
29.(4分)为了防止流感的传播,某医院每天需要喷洒大量的过氧乙酸液消毒。
(1)
(2)要配制
30.(8分)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的含量,小玉称取该纯碱样品
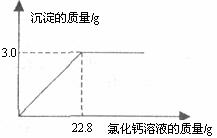
求:(1)该纯碱样品中碳酸钠的质量分数。
(2)所加入氯化钙溶液的溶质质量分数。