2008-2009学年度博山第一学期初四期中教学质量诊断性检测
化学试题
一、选择题(30分)请将正确的选项填入下列表格中
1.下列溶液的PH最小的是
A.使石蕊试液显蓝色的溶液 B.使石蕊试液显红色的溶液
C.使石蕊试液显紫色的溶液 D.使酚酞试液显红色的溶液
2.山茶花、杜鹃花、栀子花等适宜在酸性的土壤中生长,而仙人球适宜在中性偏碱的土壤中生长,现测得某土壤中的PH约为7~8,该土壤适宜种植的花卉是
A.仙人球 B.杜鹃花 C.栀子花 D.山茶花
3.一些食物的近似PH如下:葡萄3.5―4.5,苹果2.9―3.3,牛奶6.3―6.6,鸡蛋清7.6―8.0,下列说法正确的是
A.胃酸过重的人应多食苹果 B.苹果汁的酸性比葡萄汁弱
C.牛奶和鸡蛋清均为碱性 D.葡萄汁能使紫色石蕊试液变红
4.下列应用中一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤 B.服用含Al(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液 D.用NaOH溶液洗涤石油产品中的残余硫酸
5.向滴有酚酞的NaOH溶液中,逐滴加入稀硫酸至过量,下列叙述中正确的是
A.溶液由红色变为无色,PH逐渐增大 B.溶液由无色变为红色,PH逐渐减小
C.溶液由红色变为无色,PH值逐渐减小 D.溶液颜色不变,PH逐渐增大
6.下列质量增加的变化中与其他三种存在着本质区别的一种是
A.长期放置在空气中的氢氧化钠质量增加B.长期敞口放置的浓硫酸质量增加
C.久置在空气中的生石灰质量增加 D.久置在空气中的铁钉生锈质量增加
7.下列物质加入盐酸中,溶液的pH值不会明显变化的是
A.Zn B.AgNO
8.下列各组物质中,两种溶液混合后,发生了化学反应,但溶液的总质量不发生改变的是
A.氯化钠溶液和硝酸钾溶液 B.氢氧化钠溶液和稀盐酸
C.碳酸钠溶液和盐酸 D.硝酸银溶液和氯化钠溶液
9.有下列四种实验设计及操作,实验过程中其现象不足以说明CO2与NaOH溶液发生了反应的是

10.我们学过以下常见的酸、碱、盐:NaOH、Ca(OH)2、HCl、H2SO4、Na2CO3,请你整理归纳。这五种物质两两相互能发生化学反应的共有
A.4组 B.5组 C.6组 D.7组
11.四川地震灾民饮用水被严重污染,急需进行净化处理。下列净化水的单一操作中,净化程度最高的是
A.蒸馏 B.吸附沉淀 C.过滤 D.静置沉淀
12.向NaCl的饱和溶液中加入一定量的NaCl固体,保持温度不变,则溶液中
A.溶液质量增加 B.溶质质量增加
C.溶质质量分数增大 D.溶质质量分数不变
13.为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质,某同学先取2ml试样于试管中,而后进行如下实验,其中不能达到目的的是
A.加入少量盐酸,观察现象 B.加入澄清石灰水,观察现象
C.加入氯化钡,观察现象 D.通入适量CO2气体,观察现象
14.除去食盐水中所含的少量氯化钙及泥沙等杂质,进行的操作包括:①过滤②加适量盐酸③加过量碳酸钠溶液。正确的操作顺序是
A.②③① B.②①③ C.①②③ D.③①②
15.如图表示M、N两种固体物质的溶解度曲线。下列说法中正确的是

A.
B.M、N都不是易溶物质
C.P点表示t℃时,M,N的溶解度相等
D.阴影处M、N均为饱和溶液
二、理解与应用(37分)。
16.总结粗盐提纯的主要步骤:(1)_________(2) _________(3) _________
其中在(1)中玻璃棒的作用是____________________________________
在(2)中玻璃棒的作用是____________________________________
在(3)中玻璃棒的作用是____________________________________
17.欲从某固体物质的水溶液中得到该物质的晶体,对于_________的固体物质,一般采用蒸发溶剂的方法;对于_________的固体物质,一般可用冷却热的饱和溶液的方法,使晶体析出。
18.工业上采用氨碱法生产纯碱,是先向_________中通入氨气,制成饱和氨盐水;在加压的条件下不断通入_________,而使_________结晶析出;将_________加热分解即得纯碱.发生反应的化学原理是(填化学方程式)(1) __________________(2) __________________
19.向盛有少量碳酸钠固体的试管中滴加稀盐酸,看到的现象是__________________,迅速将燃着的木条伸进管口,木条会__________________,发生反应的化学反应方程式是__________________;若向纯碱中加食用醋,现象是__________________,实验说明食用醋中含有__________________。
20.请列举五种鉴别稀盐酸与澄清石灰水的方法,简要说明现象,并写出有关反应的化学方程式。
(1) ____________________________________
(2) ____________________________________
(3) ____________________________________
(4) ____________________________________
(5) ____________________________________
三、实验与探究(28分)
21.镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下:
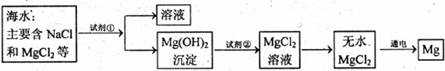
(1)为了使MgCl2转化为Mg(OH)2沉淀,试剂①可选用_________,要使MgCl2全转化为Mg(OH) 2沉淀,加入试剂①的量应________,验证MgCl2已完全转化为Mg(OH) 2的方法是________________________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是________________
(3)试剂②可以选用________________
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出反应的化学方程式:
________________________________________________
22.某化学兴趣小组,用自制的酸碱指示剂对KNO3、NaOH、HCl等溶液的酸碱性进行测定, 结果记录如下:
植物汁液
在HCl溶液中
在KNO3溶液中
在NaOH槠液中
牵牛花瓣
红色
紫色
蓝色
胡萝卜
橙色
橙色
橙色
月季花瓣
浅红花
红色
黄色
(1)经过探究,发现________根本不宜作酸碱指示剂,这三种物质中理想的指示剂是________
(2)小明是一个勤于思考、喜欢钻研的同学,发现了牵牛花瓣汁液遇NaOH溶液变成蓝色后,思考到一个问题:NaOH溶液中到底是哪种粒子使牵牛花汁液显蓝色的呢?于是他和同学们继续探究:
[提出问题]:NaOH溶液中何种粒子使牵牛花汁液发生颜色改变?
[提出猜想]:
猜想1:使牵牛花汁液变色的粒子是H2O。
猜想2:使牵牛花汁液变色的粒子是________
猜想3:使牵牛花汁液变色的粒子是________
[设计实验]
实验步骤
实验现象
-实验结论
1.向盛有少量蒸馏水的试管里,滴加两滴牵牛花汁液,振荡
溶液呈紫色
使牵牛花汁液变色的不是________。
2.向盛有少量NaCl溶液的试管里,滴加两滴牵牛花汁液,振荡
溶液呈紫色
使牵牛花汁液变色的不是________。
3.________________
溶液呈蓝色
使牵牛花汁液变色的只能是________。
四、分析与计算(5分) 相对原子质量 Na23 O 16 C 12
23.化工产品纯碱中含有NaCl,某研究性学习小组为了测定纯碱中Na2CO3的质量分数,称取含NaCl的Na2CO3固体11.