2009年临沂市中考模拟理科综合试题(四)
化学部分
说明:本试题满分150分,考试时间120分钟。
第Ⅰ卷(选择题 共52分)
(11―13题每题2分,14―17题每题3分,共18分)
11.人类的生命活动离不开氧气,若以 表示一个氧原子,则下列各图中可表示氧气模型的是
表示一个氧原子,则下列各图中可表示氧气模型的是

12.环境监测部门常采用五氧化二碘(化学式为I2O5)来测定空气中的一氧化碳含量。五氧化二碘中碘元素的化合价为
A.-5 B.+2 C.+3 D.+5
13.有道是:“水火无情”。一旦你被困在活火灾区时,要冷静地根据具体情况采取相应的求生措施,下列方法错误的是
A.拨打火警电话并到窗口呼救 B.用湿毛巾或口罩等捂住口鼻
C.直立身子朝有火光的方向逃生 D.蹲下或匍匐前进逃生
14.在物质混合(或反应)等过程中,会存在“1+1≠
A.
B.
C.温度一定时
D.
15.为防止煤气逸散使人中毒,常在煤气中加入少量的有特殊刺激性气味的乙硫醇(C2H5SH)。乙硫醇在煤气燃烧过程中也可以充分燃烧,其化学方程式为: ,则X的化学式为
,则X的化学式为
A.SO2 B.SO
16.下图是A、B两种固体物质的溶解度曲线。下列说法中错误的是

A.t
B.A、B的溶解度都随温度升高而增大
C.将t
D.t
17.现有四组物质的溶液,仅用酚酞溶液及同组物质之间相互反应就能鉴别出来的是
A.NaOH、 、HCl B.NaOH、HCl、HNO3
、HCl B.NaOH、HCl、HNO3
C.NaOH、HCl、NaCl D.H2SO4、NaCl、Na2SO4
第Ⅱ卷(非选择题 共98分)
可能用到的相对原子质量:H:1 C:12 O:16 S:32 Na:23 C1:35.5 Ba:137
二、填空简答题(化学方程式2分,其余每空1分,共20分)
1.在C、H、O、S、Na五种元素中,选择适当元素,组成符合下列要求的物质,请将其化学式填入空格中。
①天然气的主要成分___________; ②一种碱___________;
③一种常见盐___________。
2.温室效应被列为21世纪人类面临的最大威胁之一,二氧化碳是大气中的主要温室气体。为了减缓二氧化碳使全球变暖的趋势,有科学家设想:将排放到空气中的二氧化碳压缩使其液化,然后将其压人到冰冷的深海中。但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。
(1)为减少二氧化碳这种温室气体的排放,我们可以采取的措施有:_______________ _________________________________。(答一种Bp司)
(2)二氧化碳使海水酸度增加的原理用化学方程式表示为:______________________。
(3)二氧化碳在深海中的溶解度比在通常状况下的水中的溶解度___________。
3.妈妈为小刘准备的午餐有:米饭、鱼、肉和豆腐汤,这些食物中含有___________等人体所需营养素。从“合理膳食”的角度分析,这份午餐还需增加的食物有:___________(填一种)。
4.已知某无色溶液里含有硫酸,则该溶液中还可能含有是物质是___________(填序号)
A.硫酸铜 B.氯化钡 C.硫酸锌 D.氢氧化铜
上述物质不能存在于某无色溶液中的原因,能用化学方程式表示的请写出化学方程式:
(1)____________________________________________;
(2)____________________________________________。
5.等质量的Al、Mg、Zn、Fe与足量的稀硫酸反应,反应最快的是___________;放出H2最多的是___________。
6.某化工厂用石灰石制取碳酸钙,流程图为

(1)请写出上述方案中所依据反应的化学方程式
①____________________________;③___________________________。
(2)请你仍然用石灰石为原料,其它试剂任选,设计另外一种制备碳酸钙的实验方案,将你的实验方案用流程图的形式表示出来:

三、实验探究题(每空1分,共6分)
7.已知某纯碱粗产品仅含有NaCl杂质,为测定该纯碱粗产品中纯碱的质量分数,某兴趣小组的同学设计了下图所示的实验装置,取
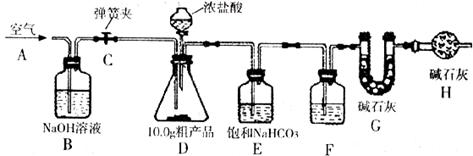
【说明】碱石灰是CaO与NaOH的固体混合物。E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为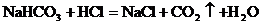 。
。
实验主要操作步骤如下:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量G的质量,得前后两次质量差为
请回答下列问题
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明__________________。
(2)F中的试剂应为___________。
(3)B装置的作用是______________________,B装置中发生反应的化学方程式为:_________________________________。
(4)装置H的作用是_________________________________。
(5)事实上
四、计算题(6分)
8.在
(1)原混合物中硫酸钠的质量;
(2)反应后所得溶液中溶质的质量分数.