2008-2009学年度枣庄市滕州第二学期九年级阶段性检测
化学试题
可能用到的相对原子质量:H l C l2 N 14 O 16 Na 23 Mg 24 S 32 Cl 35.5
Ca 40 Cu 64 Fe 56 Zn
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.下表是小明制定的食谱单,为使营养均衡,在“你的补充”栏可以选填的食物是
主食
米饭、馒头
菜肴
烧鸡缺、红烧色、花生米
乳品
牛奶
你的补充
A.煎豆腐 B.炸大虾 C.凉拌黄瓜 D.蛋糕
2.下列实验操作中,不正确的是
3.下列材料属于合成材料的是
A.聚乙烯塑料 B.陶瓷 C.硬铝 D.钢筋混凝土
4.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究所取得的开拓性成就。下图表示某反应在催化剂Pt/Al2O3/Ba表面进行的过程(图中nitrate指硝酸盐)。判断下列说法中正确的是
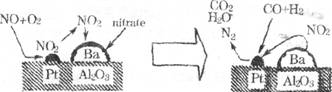
A.CO2、Al2O3属于金属氧化物 B.CO、H2O属于非金属氧化物
C.NO与O2生成NO2的反应属于置换反应 D.硝酸根离子中氮元素的化合价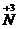
5.生活中处处有化学,在实际生活中下列物质的用途与其化学性质有关的是
A.氦气用于充灌气球 B.金刚石用于切割玻璃
C.干冰用于人工降雨 D.熟石灰用于改良酸性土壤
6.
A.降低可燃物的着火点 B.防止燃烧产物污染空气
C.降低温度到可燃物的着火点以下 D.水分解出不助燃的物质
7.有四瓶失去标签的溶液,它们的溶质分别是:①硝酸钡、②硝酸银、③氯化钠、④氯化铜,不用其他试剂就可以将它们加以鉴别,则鉴别出来的先后顺序可能是
A.④②③① B.①③②④ C.④①②③ D.②③①④
8.下列物质主要成分的化学式和名称不相符合的是
A.食盐(NaCl) B.天然气(CH4)
C.铁锈(Fe3O4) D.大理石(CaCO3)
9.对于反应:X+2 NaOH==2Y+Cu(OH)2↑,下列分析中正确的是
A.Y中一定含有钠元素 B.X和Y的相对分子质量之差为18
C.X是CuCl2或Cu(NO3)2 D.Y是Na2SO4
10.下列实验一定不需要玻璃棒的是
A.过滤含泥沙的水 B.用pH试纸测定土壤的pH
C.稀释浓硫酸 D.将品红加入水中证明分子运动
11.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表
物 质
田
乙
丙
丁
反应前质量(g)
4
1
42
10
反应后质量(g)
待测
20
6
31
关于此反应,下列认识正确的是
A.该变化的基本反应类型一定是置换反应 B.参加反应的甲、丙的质量比为1:9
C.乙、丁的相对分子质量比一定为10:9 D.甲反应后的质量为89
12.
A.
13.已知同温同压下,气体体积比等于分子数比。现有aL H2与CO的混合气体,完全燃烧后用去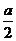 L O2,则H2与CO混合气体中,两种气体的体积比是
L O2,则H2与CO混合气体中,两种气体的体积比是
A.2:1 B.1:
14.有编号为①②③④的四瓶无色液体,仅知道是稀盐酸、食盐水、NaOH稀溶液和酚酞试液。现要求甲、乙、丙、丁四位学生进行鉴别,且每人只鉴别两瓶溶液。实验成绩评定标准为:鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格。四位学生的鉴别结果与老师的评价加下:
学生序号
鉴别结果
老师评价
甲
③号为食盐水 ④号为稀盐酸
四位学生都及格,但
是没有一位得满分
乙
①号为稀盐酸 ④号为NaOH稀溶液
丙
②号为稀盐酸 ④号为酚酞试液
丁
②号为NaOH稀溶液 ③号为稀盐酸
下列鉴别结果中正确的结论是
A.①号为NaOH稀溶液 B.②号为食盐水
C.③号为稀盐酸 D.④号为酚酞试液
15.被称为“第四类新材料”的玉米塑料学名叫“聚乳酸”,它是生物环保材料,可由乳酸(C3H6O3)合成而得,下列说法正确的是
A.乳酸中C、H、O三种元素的质量比为1:2:l
B.乳酸的相对分子质量为
C.
D.乳酸是有机高分子化合物
16.下表列出了除去物质中所含少量杂质的方法,其中正确的是
物质
所含杂质
除去杂质的方法
A
CO气体
CO2
通过足量氢氧化钠溶液,并于燥
B
NaOH溶液
Na2CO3
加入足重稀盐酸至不再产生气泡
C
CaO固体
CaCO3
加水溶解,过滤
D
FeSO4溶液
CuSO4
加入足量锌粒,充分反应,过滤
二、填空题(本题共7个小题,共23分)
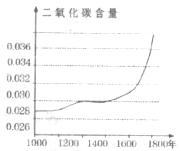
17.(2分)气象资料显示,我市年平均气温呈上升趋势。请回答:
(1)导致气候变暖的主要原因是大气中二氧化碳含量的增加。二氧化碳含量增加的因素有_____________________________(答出一点即可)
(2)下图是1000年来大气中二氧化碳含量的变化曲线图,由此图可以看出,近200年来大气中二氧化碳含量变化的特点是________________________。
18.(4分)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生以下反应:Mg+2H2O==X+H2↑。请根据以上信息回答下列各题:
(1)该饭盒底部“即热”的原理是将_____________转化为热能;
(2)已知X是一种碱,则X的化学式是_______________,你推断X的化学式的依据是_________________________;
(3)上述化学反应属于___________________(填写基本反应类型)。
19.(4分)从H、O、C、N、Na、Fe、Ca七种元素中,选择适当的元素组成符合下列要求的物质,并用化学式填空(未要求填写个数的,每空只填一种物质的化学式)。
(1)农业上用来降低土壤酸性,改良土壤结构的是___________________;
(2)农业上作为氮肥的是________________________;
(3)厨房用的酸性调味品是____________________;
(4)能作燃料的是________________________。
20.(2分)碳酸钙经过高温煅烧可分解成氧化钙和二氧化碳,这也是工业上生产生石灰的化学原理。称取两份碳酸钙,一份跟足量的稀盐酸反应,另一份在高温条件下充分煅烧,若要放出等质量的气体,则两份碳酸钙的质量比为_________________。
21.(3分)下图中连线两端的物质在通常情况下可以相互反应。下列四组选项中,符合该图要求的是_____________
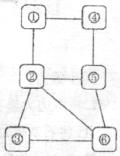
①
②
③
④
⑤
⑥
A
CO2
NaOH溶液
稀HCl溶液
Ca(OH)2溶液
CuCl2溶液
Fe
B
CaO
稀HCl溶液
Fe
稀H2SO4溶液
Na2CO3溶液
Ca(OH)2溶液
C
Fe
稀H2SO4溶液
BaCl2溶液
Cu(NO3)2溶液
Ca(OH)2溶液
Na2CO3溶液
D
Zn
稀HCl溶液
CaCO3
CuSO4溶液
NaOH溶液
FeCl3溶液
22.(4分)下图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。
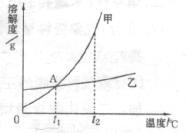
(1)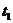 ℃时,
℃时,
(2)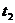 ℃时,比较两物质的溶解度大小____________。
℃时,比较两物质的溶解度大小____________。
(3)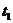 ℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是____________(写出一种即可)。
℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是____________(写出一种即可)。
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是_______________。
23.(4分)构建知识网络是一种重要的学习方法。下图是关于盐酸化学性质的知识网络,“_____________”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。完善这个知识网络:
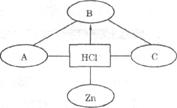
(1)写出A、B、C的化学式:
A________________;B________________;C_______________。
(2)根据自己得出的知识网络写出一个复分解反应化学方程式:_____________________
三、探究题(本题2个小题,共20分)
24.(11分)镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下;
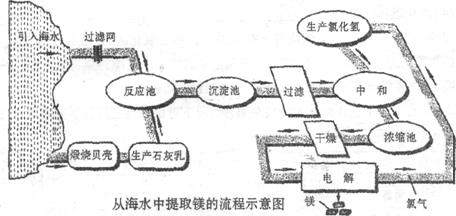
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O
Ⅳ.将MgCl2?6H2O在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅲ的有关化学方程式:
Ⅰ.贝壳煅烧成生石灰________________________________
Ⅲ.Mg(OH)2沉淀中加入盐酸中和________________________________
②步骤Ⅰ~Ⅴ中有分解反应的是(填写步骤序号):_______________
③步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有____________、_____________、酒精灯、带铁圈的铁架台、坩埚钳等。
④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点:
___________________________________________
(2)回答下列问题;
①右图为镁元素的某种粒子结构示意图,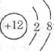 该图表示(填序号)___________。
该图表示(填序号)___________。
A.分子 B.原子 C.阳离子 D.阴离子
②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或“不活泼”)__________金属,除了能与氧气反应,还可以与氮气,二氧化碳等反应。
(3)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数。
①第一小组设计下列实验方案:称量 g镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
g镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
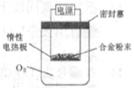
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是____________。
讨论二:若用空气代替O2进行实验,对测定结果_________(填“有”或“无”)影响。
②第二小组设计下列实验方案:称取bg镁铝合金,与足量的稀盐酸完全反应。
欲计算镁的质量分数,该实验中还需测定的一种数据是________________
25.(9分)小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究。
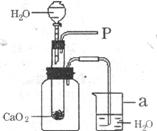
(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如图所示的装置进行实验,打开分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是___________。由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是___________,仪器a的名称是___________。
(2)根据质量守恒定律,小强认为过氧化钙与过量水反应还应产生某种含有钙元素的产物。开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH)2。请解释小强否定原假设建立新假设的理由:____________________
_________________________________
请设计一个实验方案来验证小强的新假设,并填入下表空格中:
实验步骤
可能出现的现象
结论
CaO2与H2O反应有Ca(OH)2生成
CaO2与H2O反应无Ca(OH)2生成
(3)小强通过实验证明了过氧化钙与水反应的确有氢氧化钙生成,请写出过氧化钙和水反应的化学方程式:_________________________
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出了什么结论_______________
____________________________。
四、计算题(9分)
26.(9分)将 =
=
(1)生成沉淀的质量是多少?(2)所得溶液中溶质的质量分数为多少?