2009年广东省中考模拟考试
化学试卷(六)
说明:本试题满分100分,考试时间80分钟。
选用的相对原子质量:
H:
第一卷
一、选择题(本大题14小题,每小题2分,共28分。在每小题列出的四个选项中,只有一个是正确的)
1.
A.海水晒盐 B.太阳能光解水制氢气
C.饮用水生产 D.肥皂水区分硬水和软水
2.下列关于金刚石和石墨的说法正确的是
A.组成元素都相同 B.原子排列方式都相同
C.都能导电 D.硬度都很大
3.我市是全国“节能减排”的排头兵,以下符合我市“节能减排”理念或做法的是
A.积极推广使用含铅汽油 B.禁止开发和利用地热能
C.夏天使用空调时,温度不低于26℃ D.禁止使用煤、石油、天然气等能源
4.(亚)铁磁性纳米材料因其特殊的磁学性能,在生物、医药、电子器件等领域具有广泛的应用前景。某磁性纳米材料X的一种制备方法为: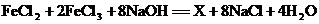 。该磁性纳米材料X的化学式是
。该磁性纳米材料X的化学式是
A.Fe(OH)2 B.Fe(OH)
5.某种冷烫精的主要成分是溴酸钠(NaBrO3),对皮肤有刺激作用,使用不当会引起皮炎。溴酸钠中溴(Br)元素的化合价为
A.+5 B.+4 C.+3 D.-5
6.现有一杯20℃的饱和硝酸钾溶液,欲改变其溶质质量分数,下列方法可行的是
A.加入一定量的硝酸钾 B.恒温蒸发部分水
C.升温到60℃ D.加入一定量的水
7.合理利用资源是当今世界所关注的话题。下列做法中不合理的是
A.设计雨水回收系统 B.建风力发电站
C.使用太阳能路灯 D.深埋废弃金属
8.元素周期表是学习和研究化学的重要工具。下图所示是某元素在元素周期表中的说明示意图。下面理解错误的是

A.A是中子数 B.B是元素符号
C.C是元素名称 D.D是相对原子质量
9.北京奥运火炬成功地在世界之颠珠峰上点燃。根据你所学的知识判断,圣火在峰顶上燃烧,设计时无需考虑的因素是
A.燃料的选择 B.太阳光线的强弱
C.火种的保存 D.大气中氧气的含量
10.从新买的衣服上取一段线头,在火上灼烧,闻到一股烧焦羽毛的气味。该衣服的面料中含有
A.羊毛 B.棉 C.麻 D.化学纤维
11.“庄稼一枝花,离不开肥当家”。化学肥料与传统农家肥配合使用,对促进农作物增产、解决粮食短缺问题起了重要作用。下列属于复合肥料的是
A.硝酸铵NH4NO3 B.碳酸氢钾KHCO3
C.尿素CO(NH2)2 D.磷酸二氢铵NH4H2PO4
12.下列实验现象的描述正确的是
A.镁带在空气中剧烈燃烧,生成黑色固体
B.将SO2通入紫色KMnO4溶液中,溶液变蓝
C.薯片上滴加碘水,薯片变蓝
D.硫酸铜溶液中滴加氢氧化钠溶液,生成红色沉淀
13.下图所示微观变化的化学反应类型,与下列反应的反应类型一致的是

A.

 B.
B.
C. D.
D.
14.向一定量的稀盐酸中加入铁粉,下列示意正确的是

第二卷
二、填空题(本大题5小题,共20分)
15.(4分)现有C、H、O、Ca、S五种元素,请选用其中一种或几种元素写出一个符合下列要求的化学式:
(1)能改良酸性土壤的碱是__________。
(2)能导致酸雨的气体是__________。
(3)能代替车用汽油的环保燃料是__________。
(4)难溶于水的盐是__________。
16.(5分)写出下列变化的化学方程式,并按要求填写所属反应类型:
(1)“曾青(CuSO4)得铁化为铜”:____________________,属于__________反应。
(2)高炉炼铁中,一氧化碳与氧化铁在高温下反应:___________________________。
(3)我国发射神舟飞船所用的长征捆绑式火箭,是用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作为液体燃料。偏二甲肼在四氧化二氮中充分燃烧,生成一种空气中含量最多的气体和两种氧化物并放出能量:______________________________。
17.(3分)生活离不开水,净化水的知识在日常生活中有着广泛的应用。
(1)用纱网可将茶叶与茶水分离,便于饮用,其应用的分离方法在化学上称为_______。
(2)要除去水中的异味和色素,常在自制净水器中加入__________。
(3)自来水厂用二氧化氯消毒杀菌,二氧化氯的化学式为__________。
18.(2分)国务院规定从2008年6月1日起,在全国范围内禁止生产、销售、使用厚度小于0.025毫米的超薄塑料袋。请你从化学角度谈谈“限塑”的原因:____________________。你认为最好选用__________作购物袋。
19.(6分)我国的瓷器举世闻名,普通陶瓷中含有铝元素,其元素符号为__________,该元素氧化物的化学式为__________。普通玻璃中含有钠元素,含该元素碱的化学式为__________,常温下其溶液的pH__________7(填“>”、“=”或“<”),若向其溶液中加水,则所得溶液的pH__________(填“增大”、“减小”或“不变”)。陶瓷和玻璃的主要成分都是硅酸盐,它们同属于__________材料(填字母)。
A.金属 B.无机非金属 C.合成 D.复合
三、解答题(本大题2小题,共15分)
20.(8分)下图是常见酸、碱、盐之间的相互转化关系。
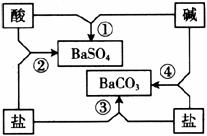
(1)写出图中相应物质的化学式:酸__________、碱__________。
(2)写出图中反应②和④的化学方程式:②_____________;④______________。
(3)总结化学反应的规律是我们学习化学的方法之一。请根据上图总结出酸、碱、盐相互反应的规律(写2点)________________________________________。
21.(7分)某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品。岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁。岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:
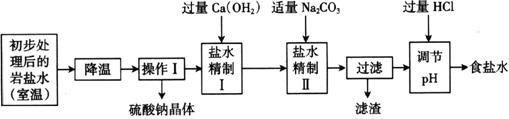
(1)“降温”能首先析出硫酸钠晶体的可能原因是__________________________。
(2)“操作Ⅰ”中的操作是__________,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有______________________________。
(3)“盐水精制Ⅰ”是除去盐水中的少量氯化镁,反应的化学方程式是:_____________。
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质,有关的化学方程式是:______________。
四、实验题(本大题2小题,共23分)
22.(11分)化学是一门以实验为基础的科学,化学所取得的丰硕成果,是与实验的重要作用分不开的。下面是实验室制取和收集气体的一些常用装置,请结合装置回答问题:
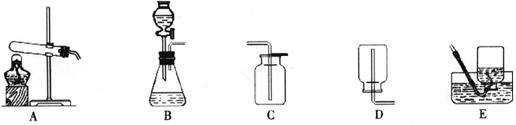
(1)在实验室里下图所示的三种方式都可以制得氧气:
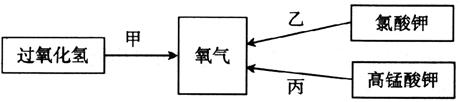
实验室若用乙方法制氧气选用的发生装置是__________(填字母代号);甲、乙两种方法中都要用到MnO2,MnO2在反应中起__________作用。用甲方法制取氧气的化学方程式是______________________________。
(2)甲、乙、丙三种制氧气的方法中,你认为较好的是______方法,理由是__ ___。
(3)实验室用大理石和稀盐酸反应制CO2应选用的发生装置是__________,收集CO2通常用C装置而不用D或E是因为____________________,检验集气瓶中CO2是否收集满的方法是______________________________。
23.(12分)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为______________________________。
(2)【实验】如下图所示:
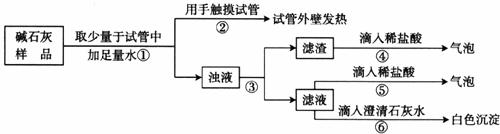
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ__________(填“成立”或“不成立”);
b.操作④发生化学反应的方程式为__________________________,由操作⑤⑥的现象判断:滤液中含有__________(写化学式),由此判断猜想Ⅰ__________(填“成立”或“不成立”);
c.综合a和b的结论,判断该样品变质情况为______________________________。
(4)【拓展】
由上述实验说明,实验室中“碱石灰”应______保存;操作③中玻棒的作用是__________。
五、计算题(本大题2小题,共14分)
24.(6分)苹果醋是一种利用苹果发酵制成的饮料,具有一定的保健功能。苹果酸(化学式为C4H6O5)是这种饮料的有效成分。计算:
(1)苹果酸的相对分子质量是__________。
(2)苹果酸中碳氢氧三种元素的质量比__________。
(3)苹果酸中碳元素的质量分数是__________(结果精到0.1%)。
25.(8分)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如下图所示。
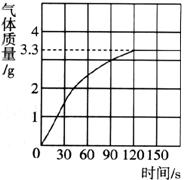
(1)水垢中碳酸钙的质量分数是多少?
(2)假设水垢中除碳酸钙和氢氧化镁外,不含有其他杂质,溶解10g水垢,至少需要质量分数为10%的盐酸的质量是__________(最后结果保留一位小数)。