2008-2009学年度烟台市招远第一学期初三期末考试
化学试卷
说明:本试题满分100分,其中卷面分5分,考试时间90分钟。
第Ⅰ卷(选择题部分 共30分)
一、我会选择(本题共10个小题,每小题只有一个选项符合题意,每小题1分,共10分)
1.学习化学后,我们懂得世界是物质的,物质是变化的。下列日常生活中的变化属于化学变化的
A.蜡烛熔化 B.酒精挥发
C.粮食发酵变成酒 D.玻璃杯破裂
2.下列家庭中常用的物质中属于纯净物的是
A.自来水 B.白酒 C.米醋 D.蒸馏水
3.在实验室里,下列操作中正确的是
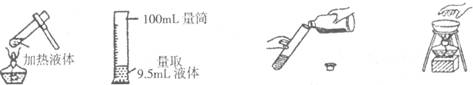
A.给液体加热 B.量取液体 C.倾倒液体 D.移走蒸发皿
4.某地发生暴雨灾害后,使当地饮用水受到污染。医疗救护人员打算给当地居民提供一些关于饮用水的处理建议,请你帮助判断以下建议不合理的是
A.用明矾使水中悬浮颗粒沉降下来
B.通过过滤除去不溶性的颗粒
C.用漂白粉对水进行消毒杀菌
D.通过观察只要水无色透明,不用加热煮沸,就可以放心饮用
5.用托盘天平称量易潮解、有腐蚀性的药品时,应该将固体
A.直接放在托盘上称量 B.放在垫了纸的托盘上称量
C.先放入烧杯中,再放在托盘上称量 D.溶解后再称量
6.下列有关实验操作正确的是
A.使用后剩余的药品不要乱丢,要放回原试剂瓶中
B.可用嘴吹灭酒精灯
C.酒精灯不用时,要用灯帽盖上,防止酒精挥发
D.清洗玻璃仪器后,内壁上有少量水珠即为干净
7.下列化学反应,既不属于化合反应,也不属于分解反应的是
A.水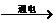 氧气+氢气 B.氢气+氧气
氧气+氢气 B.氢气+氧气 水
水
C.甲烷+氧气 二氧化碳+水 D.铁+氧气
二氧化碳+水 D.铁+氧气 四氧化三铁
四氧化三铁
8.下列各组物质中,是按单质、化合物、混合物顺序排列的是
A.自来水、氧化镁、液态空气 B.稀有气体、碳铵、食盐
C.氢气、蒸馏水、石灰水 D.二氧化碳、铁、氢氧化钠溶液
9.R元素原子的最外层电子数为2,下列关于R原子和R离子的说法正确的是
A.化学性质相同 B.电子层数相同
C.相对原子质量相同 D.最外层电子数相同
10.现有质量分数为10%的某溶液,若使其质量分数增大一倍,可采用方法是
A.将溶剂蒸发掉一半 B.将溶质质量增大一倍
C.蒸发溶剂的质量为原溶液质量的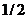 D.溶质、溶剂质量同时减少
D.溶质、溶剂质量同时减少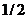
二、我能选择(本题包括10个小题,每小题2分,共20分。每小题有一至二个选项符合题意,多选错选不得分,漏选一个扣1分)
11.下列仪器中,能直接用酒精灯加热的有
①试管 ②量筒 ③蒸发皿 ④烧杯 ⑤集气瓶 ⑥试剂瓶
A.①③ B.①④ C.③⑤⑥ D.①③④
12.某同学用托盘天平称量食盐时,错误地将食盐放在右盘里,砝码放在左盘里,称得食盐质量为
A.
13.下列操作或现象与分子对应的特性不一致的是
选项
操作或现象
分子的特性
A
给篮球充气
分子很小
B
100mL酒精和100mL水混合在一起,体积小于200mL
分子是有质量的
C
在花园中可闻到花的香味
分子是运动的
D
加热氧化汞可得到金属和氧气
分子是可以再分的
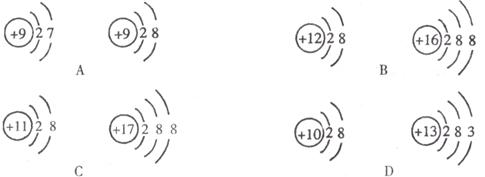
14.下列各组粒子结构示意图中,前者表示阳离子,后者表示阴离子的是
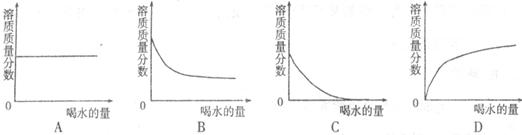
15.人体胃液中含有少量盐酸,下列图像能正确反映人喝水时,胃液中盐酸溶质质量分数变化情况的是
16.如下图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面a和b仍然保持不变,该物质可能是
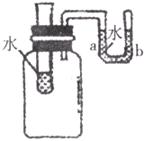
A.氢氧化钠固体 B.蔗糖 C.硝酸铵晶体 D.氯化钠晶体
17.质子和中子都是由u夸克和d夸克组成,u夸克带电量为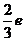 ,d夸克带电量为
,d夸克带电量为 ,
,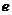 为基元电荷。下列论断可能正确的是
为基元电荷。下列论断可能正确的是
A.质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
B.质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成
C.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
D.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成
18.善于用化学的眼光看世界,能够提高我们的科学素养。你认为下列变化事实和相应解释不一致的是
事 实
解 释
A
冬天常在汽车的水箱中加入少量乙二醇等物质,防止水箱中的水结冰
乙二醇形成的水溶液凝固点很低
B
食盐水溶液能够导电
食盐在水中电离成自由移动的离子
C
一杯蔗糖水,上部与下部一样甜
溶液是均一的、稳定的混合物
D
温度计中的水银(汞)热胀冷缩
原子本身的大小发生了改变
19.用下图所示的装置进行水的电解实验时,有以下描述:
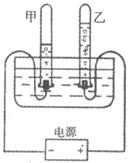
①向水中加入少量氢氧化钠,能使水电解产生气体的速度变大
②甲、乙两试管内收集到的气体的体积比约为2┱1
③甲试管内产生的气体能燃烧,且燃烧时火焰呈淡蓝色
④乙试管内产生的气体能使带火星的木条复燃
以上描写中正确的是
A.①②③④ B.③ C.①② D.①②③
20.注射用链霉素试验针的药液配制方法如下
(1)把
(2)取0.2mL溶液①加水稀释到1.0mL,得溶液②
(3)取0.1mL溶液②加水稀释到2.0mL,得溶液③
(4)取0.2mL溶液③加水稀释到2.0mL,得溶液④
最终得到的试验针药液(溶液④)中,链霉素的质量分数是(由于整个过程中药液很稀,密度近似看作
A.25% B.0.5% C.0.05% D.2.5%
第Ⅱ卷(非选择题 共65分)
三、我会填空(每空1分,共32分)
21.(3分)某原子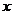 的相对原子质量为23,该原子的原子核内质子数比中子数少1个,则该原子核内质子数为__________,中子数为__________,核外电子数为__________。
的相对原子质量为23,该原子的原子核内质子数比中子数少1个,则该原子核内质子数为__________,中子数为__________,核外电子数为__________。
22.(7分)学习化学要逐步建立“微粒观”,我们已经学习和接触了以下几种微粒:①分子②原子③离子④原子核⑤质子⑥中子⑦电子。请用其序号恰当地填写以下空白:
(1)通常带电的微粒有________,一定带正电的是________,呈电中性的有________;
(2)能构成物质的微粒有__________,化学变化中最小的微粒是__________;
(3)质量最小的微粒是__________,在同一原子中数目相等的微粒是__________。
23.(3分)1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了下面的实验。他们用一束带正电的、质量比电子大得多的高速运动的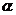 粒子轰击金箔,发现:①大多数
粒子轰击金箔,发现:①大多数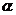 粒子能穿透金箔而不改变原来的运动方向;②一小部分
粒子能穿透金箔而不改变原来的运动方向;②一小部分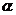 粒子改变了原来的运动方向;③有极少数
粒子改变了原来的运动方向;③有极少数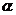 粒子被弹了回来。由此你能推测出关于原子内部结构的信息是(任写三点):
粒子被弹了回来。由此你能推测出关于原子内部结构的信息是(任写三点):

(1)________________________________________;
(2)________________________________________;
(3)________________________________________。
24.(6分)当你学习了化学之后,就要用到很多化学符号,这样就给你的学习带来了很多方便。请你用符号回答下列问题:
(1)硫__________ (2)镁__________ (3)硅__________
(4)氯__________ (5)2个氮原子__________ (6)钠离子__________
25.(4分)写出下列溶液中的溶质和溶剂的名称:
(1)碘酒:溶质__________,溶剂__________。
(2)氢氧化钠溶液:溶质__________,溶剂__________。
26.(6分)元素周期表是学习和研究化学的重要工具,下表是元素周期表的一部分。回答下列问题:
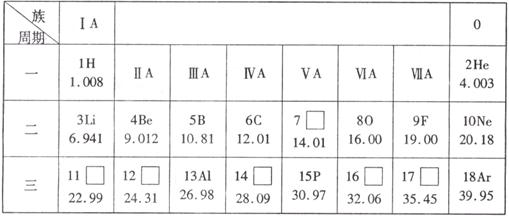
(1)氟原子的相对原子质量为__________。
(2)相对原子质量为35.45的元素属于__________(填“非金属”、“金属”)。
(3)地壳中含量最多的金属元素是__________。
(4)表中不同种元素最本质的区别是__________(填字母)。
A.相对原子质量不同 B.中子数不同 C.质子数不同
(5)分析第二周期的元素,从锂到氖,随着原子序数的递增,它们的核电荷数有什么变化规律?
(6)分析第ⅠA族各元素原子最外电子层上电子数有什么特点?
27.(3分)淡水是重要的自然资源,淡水资源不足,将严重影响人类的生存和可持续发展。下表是淡水资源紧缺程度与人均水量的关系,请结合下表回答:
水资源紧缺程度
轻度缺水
中度缺水
重度缺水
极度缺水
人均水量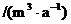 (其中a为年)
(其中a为年)
1700―3000
1000―1700
500―1000
<500
(1)我国人均水量约为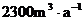 ,居世界第八十几位,水资源紧缺程度为_______ ___________。因此,保护水资源、节约用水是我们每个公民的义务。
,居世界第八十几位,水资源紧缺程度为_______ ___________。因此,保护水资源、节约用水是我们每个公民的义务。
(2)研究表明,一节含汞、镉、铅等金属的电池所造成的污染可使60t水无法饮用,可使
(3)为了保护有限的淡水资源,在生活中你将采取哪些措施来节约用水和防止水体污染?
四、我会解释、归纳(12分)
28.(2分)蔗糖放入水中,为什么糖不见了,水变甜了?
29.(4分)汽油能洗去衣服上的油渍,洗洁精能洗去餐具上的油渍,请解释这两者有什么不同。
30.(2分)前些日子的一场大雪,给市民出行带来诸多不变,在除雪过程中,融雪剂发挥了很大的作用。某公司生产的融雪剂是由氯化镁、氯化钠、硝酸钠混和而成。请你解释融雪剂除雪的原理。
31.(4分)分析与归纳是化学学习中重要的思想方法,小明同学在学习了物质的分类知识后,从宏观上得出了如下图所示的知识结构:

请你参照它的做法,从微观上把构成物质的微粒之间的关系总结出来。
五、我会探究(15分)
32.(6分)善于观察事物,开展科学探究是学习化学的重要学习方法。小张同学对平日学习中使用白纸的成分产生了兴趣,展开了探究。
提出问题:白纸的组成成分中含有什么元素?
进行猜想:白纸的组成中可能含有碳元素和氢元素。
实验探究:请你把小张同学设计验证猜想的实验方案填入下表。
实验用品:火柴、干燥的白纸、光洁干燥的小烧杯、澄清石灰水
实验步骤
实验现象
结论
33.(5分)为监测某厂排放的污水中银离子的含量,需配制

请你帮助解决以下问题:(注:有些空白填“变大”“变小”“不变”)
(1)图示的操作中,_________操作有错误,改正方法是__________________________。
(2)若其它操作均正确,量取水时仰视读数,则所配溶液的溶质质量分数_________。
(3)若在进行F操作时,有少量溶液洒落,则所配溶液的溶质质量分数_________。
(4)E操作的作用是____________________________________。
34.(4分)在点燃蜡烛时,小红发现有一根烛芯沾有食盐的蜡烛比普通蜡烛燃烧的时间长一些。请你与小红一起探究,并回答下列有关问题。

[提出问题]食盐是否能延长蜡烛的燃烧时间?
[猜 想]一定量的食盐可延长蜡烛的燃烧时间
[实验探究]
实 验:探究不同量的食盐对蜡烛燃烧时间的影响
实验方案:取6支相同的蜡烛,在其中5支蜡烛的烛芯周围分别放入不同量的食盐,另1支蜡烛作对照实验,分别测定它们的燃烧时间。
实验结果:
食盐质量(g)
0
0.1
0.5
0.7
0.9
1.0
燃烧时间(分钟)
10
15
18
23
25
27
燃烧稳定性
正常
正常
正常
正常
易灭
极易灭
实验结论:对上表所得实验结果分析,你可初步得出的两点结论是:
①________________________________________________
②________________________________________________
实验反思:
①此实验方案还存在一些问题值得进一步研究,如(至少写出一点):________________。
②请你根据上述实验结果,为蜡烛生产厂家提一条有实际应用价值的建议。_________。
六、我会计算(6分)
35.(6分)实验室要配制
(1)请你设计出两种配制方案,填入下表中。
方 案
药品用量
方案一:
方案二:
(2)从操作方法简便上看,你设计的两种方案中,第________________种方案更好。