2008年全国初中学生化学素质和实验能力竞赛(湖北省赛区初赛)
化学试卷
试卷说明:
1本试卷包括第Ⅰ卷和第Ⅱ卷。第Ⅰ卷为选择题,共40分;第Ⅱ卷为非选择题,共60分。全卷满分100分。答题时间为120分钟。
可能用到的相对原子质量:
H
第Ⅰ卷(选择题,共40分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题有1个或2个选项符合题意。请将所选答案的序号填写则下表相应的空格内,只写在试题旁无效)
1.下列物质按单质、氧化物、化合物、混合物的顺序排列的是
A.金刚石、生石灰、粗食盐、冰水 B.水银、干冰、熟石灰、天然气
C.苛性钠、铁锈、纯碱、石油 D.硫磺、液态氧、粗食盐、胆矾
2.类推的思维方法在化学学习与研究中是一种常用的推理方法,如乙酸(CH3COOH)→过氧乙酸(CH3COOOH),氧化钠(Na2O)→过氧化钠(Na2O2);由此类推,过氧化钙的化学式为
A.Ca2O B.
3.如果按某种标准能将Cu2O、Na2SO3、NO划为同一类物质,则下列物质中能划分为此类物质的是
A.K2SO4 B.K2MnO
4.碳在氧气中燃烧,下列说法中符合质量守恒定律的是
A.
B.
C.
D.
5.氯气和氧气都是活泼的非金属单质,在一定条件下它们都能跟甲烷起反应。已知O2与CH4充分反应后的生成物是CO2和H2O,据此推知,Cl2与CH4充分反应后的生成物是
A.CCl4和HCl B.CCl4和Cl
6.锆(Zr)的一种氧化物是耐高温的新型陶瓷材料,经测定,锆原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为233,若锆钻氯化物和这种氧化物中的化合价相同。则氧化物的化学式为
A.Zr2O B.ZrO C.Zr2O 3 D.ZrO2
7.下列说法中正确的是
A.同种溶质的饱和溶液一定比它的不饱和的浓度大
B.饱和溶液降低温度析出晶体后就变为不饱和溶液
C.某饱和溶液温度升高时,若溶液的质量不变,则溶质的质量分数不变
D.固体溶质的饱和溶液温度降低时必定有晶体析出
8.在
A.溶质的质量不变 B.溶质的质量减少
C.溶质的质量分数减少 D.溶质的质量分数增大
9.有三种金属M、N、R,其氧化物中只有N的氧化物溶于水,且水溶液pH大于7;又知R能从硝酸银溶液中置换出银,R不溶于盐酸;M能在氧气中剧烈燃烧,火星四溅,生成黑色固体。则M、N、R在金属活动顺序表中的正确位置是
A.M、N、(H)、R B.R、M、(H)、N
C.R、(H)、M、N D.N、M、(H)、R
10.有一种含氧的多原子分子由m 种元素组成,下列叙述正确的是
A.m=1
B.m≥
11.初中化学实验报告中有如下记录,其中实验数据合理的事
A.用50 mL量筒量取5.26 mL水
B.用托盘天平称取
C.用pH试纸测得苹果汁的pH为3.2
D.用温度计测得某NaOH溶液的温度为
12.在pH=1的溶液中能大量共存并且溶液为无色透明的离子组是
A.Ca2+、Na+、NO3-、SO42- B.Mg2+、Cl-、Al3+、SO42-
C.K+、Cl-、HCO3-、NO3- D. Ca2+、Na+、Fe3+、NO3-
13.为了提高煤燃烧的热效率并减少CO有害物质的污染可采取的措施是
A.通入大量的空气 B.将固体燃料粉碎,使之充分燃烧
C.控制煤的生产 D.将煤经过处理,使之转化为气体燃料
14.“可燃冰”又称天然气水合物,它是在海底的高压低温条件下形成的,它的外观像冰,1体积“可燃冰”可储藏100-200体积的天然气。下面关于“可燃冰”的叙述中,不正确的是
A.“可燃冰”有可能成为人类未来的重要能源
B.“可燃冰”是一种比较洁净的能源
C.“可燃冰”提供了水可能变成油的证据
D.“可燃冰”的可燃成分是甲烷
15.称量烧碱时,不将它放在纸上,而是放置在烧杯等玻璃器皿中,主要是因为
A.放在纸上称量不如置于烧杯中称量精确
B.配制溶液通常是在烧杯中进行的,直接在烧杯中进行称量的目的是为了减少操作步骤
C.烧碱易潮解,且腐蚀性强
D.纸上称量易粘上杂质,降低所配溶液纯度
16.将
A.A+B=C+D
B.A+2B=
C.
17.某有机物在氧气中完全燃烧,生成二氧化碳和水的质量比为22:9,则该有机物是
A.C2H4 B.C12H22O
18.由Na、S、O、H四种元素中的二种或三种元素组成四种常见的化合物。其中甲能跟氯化钡反应生成一种硫酸盐和另一种盐,乙能跟氢氧化钠反应生成盐和水,丙能跟盐酸反应生成盐和水,丁呈中性可以氧化钙或二氧化碳发生化合反应,生成相应的碱或酸,下列说法:①甲一定是硫酸钠②乙可能是硫酸③丙一定是氢氧化钠④丁一定是水,正确的一组是
A.①②③ B.②③④ C.①③④ D.①②④
19.向t℃时饱和的Na2CO3溶液中加入n g无水Na2CO3,会析出m g Na2CO3?10H2O,则(m-n)的值为
A.饱和溶液失去水的质量 B.饱和溶液失去溶质的质量
C.饱和溶液失去水和溶质的质量之和 D.其数值为0,即溶液质量不变
20.在天平两端的烧杯中盛有等质量,等质量分数的盐酸,天平平衡。分别向一只烧杯中加入一定质量的镁,另一只烧杯中加入一定质量的铝,充分反应后,天平平衡,则加入Mg和Al的质量比可能是
A.11:12
B.32:
第Ⅱ卷(非选择题,共60分)
二、填空题(本题共2小题,第21小题5分,第22小题7分,共12分)
21.(5分)在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾又混有紫红色物质,认为反应过程如下:
①2KClO3+2MnO2=
③B+D=2KCl+( )+C↑
写出其中的化学方程式: ;
在反应中MnO2的作用是: ;
A和B的化学式分别为 和 。
22.(7分)有A、B、C、D四种元素,A的原子核外有3个电子层,且第3电子层上的电子数比第2电子层的电子数少1;B元素的某氧化物分子组成为BO3,其中B元素与氧元素的质量比为2:3,且B原子核内质子数与中子数相等;C-和D2+的电子层结构与氖原子相同。
(1)写出下列元素的元素符合:A ,C ,D 。
(2)B元素形成常见单核离子的化学符号: ,写出由该离子形成的常见化合物,如 (任写一个符合要求的化学式)。
(3)已知A元素的单质能与碘化钾(KI)溶液发生反应,生成A元素的无氧酸盐和碘单质(I2),这一反应的化学方程式为 。
三、实验题(本大题共2小题,第23小题8分,第24小题11分,共19分)
23.(8分)某校化学学习小组的同学测定标准状态下氧气的密度。设计了以下的实验操作步骤:
①按下图装配实验装置:
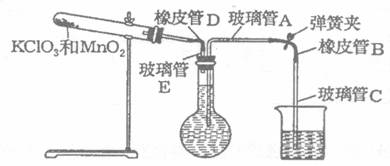
②洗净试管,然后充分干燥;
③向500 mL烧瓶里装满水,向500mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧;
④称得试管的质量为
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯的水面一致,再关闭弹簧夹,然后把烧杯中的水倒
掉;
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止;
⑦反应完毕后把装置放置冷却到室温;
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹;
⑨用500 mL量筒测得烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为
279.7 mL ;
⑩再称量冷却后试管的质量为
根据上述实验,回答下列问题:
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其
理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?
。
(3)在标准状况下氧气的密度为 ;混合物中MnO2的质量分
数为 。
24.(11分)某CuO粉末中混有少量Cu2O,现有一课外活动小组利用下图所示装置测定其
中Cu2O的含量,请根据图示内容回答下列问题:

(1)X是常见还原性气体CO、H2中的一种,请根据组合装置判断X的化学式为 ,
A装置的作用是 。
(2)B装置的作用是 。若缺少它,将直接导致反应后 装置内的物质的质量偏差。
(3)已知Cu2O在加热的条件下也能被X气体还原为Cu,写出C装置中所有发生反应的化学方程式
。
(4)已知反应前CuO和Cu2O的总质量为m
(5)E装置的作用是 。
(6)若进入C中的气体换成两种气体中的另外一种,同样要求用该装置完成Cu2O含量的测定实验,则D中的药品应改换为 。
四、实验探究(本大题共2小题,第25小题9分,第26小题12分,共21分)
25.某化学学习小组在完成金属与盐溶液反应的探究实验时,针对将少量金属钠投入硫酸铜溶液中会有什么现象发生?生成什么物质?甲、乙两个同学为此争论,甲说:“钠在金属活动顺序中排在铜的前面,反应会置换出铜”。乙说:“不对!反应会放出气体,产生蓝色沉淀”。乙的理由是 。
为了验证甲、乙两位同学的观点,他们完成了该实验,在实验中果然产生气体和蓝色沉淀,但甲又说:“那会不会蓝色沉淀掩盖了红色铜的现象呢”?你如何用实验证明该蓝色沉淀中不含红色的铜: 。
写出钠与硫酸铜溶液反应的化学方程式 。
推断少量金属钠投入到氯化铁溶液中产生的现象: 。
26.某学习小组的同学向
(1)甲同学认为该白色固体可能是NaOH与Na2CO3的混合物。你认为该固体还可能是
或 或 。
(2)如果甲同学的结论是正确的,请你设计实验证明白色固体中存在NaOH,请将方案填入下表中:
实验操作
实验现象
结论
(3)乙同学称量所得白色固体的质量为
五、计算题(8分)
27.将10 gCuO粉末加入到
求:(1)所加稀硫酸的溶质的质量分数;
(2)当m取何值时,才能满足加入的铁粉和得到的固体质量相等。