第四单元 测试A卷
测试时间:100分钟 总分:100分
一、选择题(每题3分,共36分)
1.下列粒子带正电荷的是 ( )
A.电子 B.中子 C.原子核 D.原子
2.质量相等的铜和铁所含的原子个数 ( )
A.铜>铁 B.铜=铁 C.铜<铁 D.无法确定
3.氢原子核内有一个质子,下面的推论正确的是 ( )
A.氢的原子核内必然有一个中子 B.氢原子必然带一个单位的正电荷
C.氢原子核内必然有一个电子 D.氢原子中必须有一个电子
4.具有下列核电荷数的原子中,化学性质最稳定的是 ( )
A.12
B.
5.最外层具有8个电子的微粒是 ( )
A.阳离子 B.阴离子 C.稀有气体原子 D.无法确定
6.下列结构示意图表示的粒子中,属于离子的是 ( )
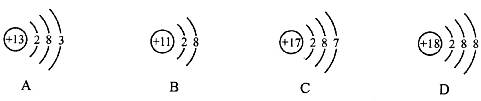
7.某物质经分析只含一种元素,则该物质不可能是 ( )
A.单质 B.纯净物 C.化合物 D.混合物
8.国际互联网报道:目前世界上有20亿人患有缺铁性贫血。我国即将启动“酱油补铁工程”。这里的铁是指 ( )
A.铁原子 B.铁元素 C.铁单质 D.氧化铁
9.2003年元月5日,我国载有模拟宇航员的“神舟”四号飞船在预定区域成功着陆。运送飞船的长征二号F捆绑式大推力火箭的发动机是陕西省某研究所研制的。火箭主要燃烧偏二甲肼(化学式为C2H8N2)。下列有关偏二甲肼组成的叙述,正确的是 ( )
A.由2个碳原子、4个氢气分子、一个氮气分子组成
B.由碳、氢、氮三种元素组成
C.由2个碳原子、8个氢原子、2个氮原子构成
D.组成元素碳、氢、氮的质量比为1:4:1
10.分析HCl、X、HClO、KClO3、KClO4的排列顺序规律,可知X代表的是 ( )
A.NaCl B.Ca(ClO)
11.某氮的氧化物中,氮、氧元素的质量比为7:16,则该氧化物的化学式为 ( )
A.NO
B.NO
12.要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三铁的质量比是 ( )
A.3:2 B.1:
二、填空题(第13题每空1分,其余各题每空2分,共40分)
13.用符号表示:
(1)氧元素_____________;(2)氧气______________;(3)n个氧原子_____________;
(4)钠离子____________;(5)4个镁离子___________;(6)氢氧根离子_____________。
14.某元素在人体内能调节体液平衡等,缺乏该元素会造成心率不齐,过量时会使人恶心腹泻。该元素的原子结构示意图为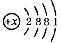 ,则
,则 =______,该原子有______个电子层,此元素应属于______(填“金属”或“非金属”)元素。
=______,该原子有______个电子层,此元素应属于______(填“金属”或“非金属”)元素。
15.下表是某地市场上销售的一种“加碘盐”包装袋上的部分文字说明。请根据此表,结合初中学过得化学知识,回答下列问题:
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20一40mg/kg
储藏方法
密封避光、防潮
食用方法
烹调时待食品熟后加入碘盐
(1)碘酸钾属于哪类物质?__________ (填“纯净物…“混合物”“单质”或“氧化物”)。
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时__________。
(3)我国规定,食盐含碘量为每千克食盐含碘
16.“9?
17.当前发展较快,高效低毒的灭火剂叫“
1301____________________,122____________________,2402____________________。
18.A、B两元素的原子结构示意图如下:
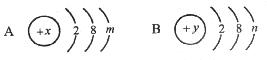
A中m=7,则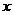 =________,B中y=12,则n=__________。A、B两种元素形成的化学式是______________。
=________,B中y=12,则n=__________。A、B两种元素形成的化学式是______________。
19.1996年科学家在宇宙深处发现了H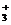 离子和H3分子,请回答:
离子和H3分子,请回答:
(1)1个H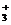 离子中含有________个原子________个电子。
离子中含有________个原子________个电子。
(2)构成H3分子的原子的结构示意图是________。
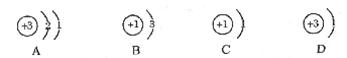
三、简答题(每题4分,共8分)
20.铜是由铜原子直接构成的,原子中存在着带电荷的粒子(质子和电子),取一铜块用试电笔测试,带电吗?为什么?
21.通过查表得到:氧的相对原子质量为16.00,硫的相对原子质量为32.06。甲、乙两个同学由此数据对氧原子质量和硫原子质量的关系得出下列结论。
甲同学:1个硫原子质量几乎是1个氧原子质量的2倍。
乙同学:1个硫原子质量不一定是1个氧原子质量的2倍,甚至l个硫原子质量可能比1个氧原子质量还小。
请你对上述两位同学的结论做出评价,并说明理由。
四、计算题(16分)
22.(9分)人体缺钙易产生“骨质疏松症”。一体重为
(1)乳酸钙的相对分子质量。
(2)乳酸钙中钙元素的质量分数。
(3)缺钙病人每天需服乳酸钙的质量。
23.(7分)某药物的主要成分为C9H8O4(其他成分不含碳元素),已知该药物的含碳量为48%,则该药物中C9H8O4的质量分数是多少?