2008年江苏省连云港市中考
化学试卷
可能用到的相对原子质量:H―1 C―12 O―16 Na―23 Mg―24 S―32 Cl―35.5 Fe―56 Zn―65 Ba―137
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.从今年6月1日起,在全国范围内禁止生产、销售、使用厚度小于0.
A.减少“白色污染” B.节约资源
C.给商家增加收入 D.引导人们提高环保意识
2.下列燃料中,属于化石燃料的是
A.柴草 B.氢气 C.乙醇 D.石油
3.下列化学用语表示正确的是
A.铝的元素符号:AL B.2个氢原子:H2
C.2个氯分子:2Cl2 D.镁离子:Mg+2
4.下列不属于化学变化的是
5.下列物质按照单质、氧化物、混合物的顺序排列的是
A.铁、氧化铁、氯化铁 B.冰、干冰、可燃冰
C.氧气、二氧化碳、空气 D.金刚石、铁矿石、石灰石
6.已知氯原子的结构示意图为 ,下列说法正确的是
,下列说法正确的是
A.氯原子核内有17个质子
B.一个氯原子的质量为
C.在化学反应中氯原子易失电子 D.氯离子Cl-核外有17个电子
7.施肥是农业增产的重要手段。下列属于含磷复合肥料的是
A.硝酸钾 B.磷酸氢二铵 C.硝酸铵 D.磷酸钙
8.下列化学方程式正确的是
A.4P+5O2 2P2O5 B.KMnO4 =K2MnO4+MnO2+O2↑
2P2O5 B.KMnO4 =K2MnO4+MnO2+O2↑
C.2Fe+6HCl=2FeCl3+3H2↑ D.2Ag+CuCl2=2AgCl+Cu
9.规范的实验操作是获得正确实验结果和保障人身安全的前提。以下图示的实验操作中,正确的是
10.水是生命的基础,没有水就没有生命。下列有关水的说法正确的是
A.水是由两个氢元素和一个氧元素组成的
B.无色、无臭、清澈透明的水就是纯水
C.锅炉中使用硬水容易产生水垢,严重时会引起爆炸
D.婴幼儿、青少年长期饮用纯净水有益健康
11.摄取食物是维持生命和健康的基本需求。下列有关说法不正确的是
A.食用鱼、瘦肉、大豆等食物可为人体提供丰富的蛋白质
B.油脂是重要的营养物质,但摄入过多也不利于健康
C.维生素是人体营养素之一,可从水果、蔬菜等食物中摄取
D.微量元素在人体内含量很小,摄入量多少与健康无关
12.下列有关说法正确的是
A.合金、合成纤维、合成橡胶等都是重要的有机合成材料
B.洗涤剂具有乳化功能,可以去除餐具上的油污
C.涤纶、腈纶、羊毛等都属于天然纤维
D.电木插座开裂后,可用加热熔化的方法修补
13.为了鉴别下列各组物质,所加试剂正确的是
A.盐酸和硫酸钠溶液――酚酞溶液 B.食盐水和盐酸――硝酸银溶液
C.木炭粉和氧化铜――稀硫酸 D.澄清石灰水和氢氧化钠溶液――盐酸
14.在家庭中进行的下列实验或做法可行的是
A.用食醋区分食盐和纯碱
B.将食盐经溶解、过滤、蒸发来制纯净的氯化钠
C.用加有铁强化剂的酱油与食醋反应制氢气
D.用汽油洗掉白衬衫上的铁锈
15.钢铁是使用最多的金属材料,但每年因锈蚀而损失的数量巨大,防止金属腐蚀已成为科学研究中的重大问题。以下有关金属腐蚀的叙述不正确的是
A.钢铁在潮湿的空气中比在干燥的空气中更易锈蚀
B.钢铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学反应
C.铝比钢铁中的铁活泼,因而铝的抗腐蚀性能比钢铁差
D.在钢铁表现刷漆或镀耐腐蚀金属都可防止钢铁锈蚀
16.配制
A.将氢氧化钠固体置于滤纸上称量
B.俯视量筒刻度读出所取水的体积
C.将氢氧化钠固体置于托盘天平的右盘、砝码置于左盘称量
D.将94mL水倒入盛有
17.为了除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是
物质
选用试剂(过量)
操作方法
A
Cu(CuO)
氧气
通入氧气并加热
B
CO2(HCl)
氢氧化钠溶液
气体通过盛有氢氧化钠溶液的洗气瓶
C
N2(O2)
铜粉
气体通过炽热的铜粉
D
KCl溶液(K2CO3)
氯化钙溶液
加入氯化钙溶液充分反应后过滤
18.以下摘录的是某些同学对所学知识的整理归纳,你认为正确的是
A.若使可燃物的温度降到着火点以下就能灭火
B.含有碳元素的化合物都属于有机物
C.生成一种单质和一种化合物的反应就是置换反应
D.合金一定是由两种或两种以上金属熔合而成的
19.下列图象与对应实验相符合的是
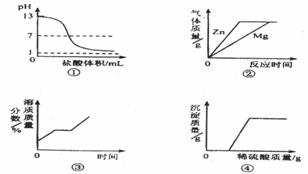
A.图①表示向pH=13的氢氧化钠溶液中逐滴加入pH=1的盐酸
B.图②表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌
C.图③表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出
D.图④表示向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸
20.将CO通入盛有
A.2.
二、(本题包括4小题,共19分)
21.(6分)请按要求选择下列物质填空(填写化学式):
硫 氮气 氧气 硫酸 硝酸铵 二氧化碳 氢氧化钠 氢氧化钙
(1)空气中含量最多的气体 ;
(2)可用于人工降雨和灭火的物质 ;
(3)可用于制肥皂、造纸等工业的碱 ;
(4)在氧气中燃烧发出蓝紫色火焰的固体 ;
(5)能用于金属除锈的重要化工原料 ;
(6)溶于水时,能使溶液温度降低的物质 。
22.(4分)一定条件下,物质A( )与B(
)与B( )反应生成C(
)反应生成C( ),下图是其反应前后分子及其数目变化的微观示意图(
),下图是其反应前后分子及其数目变化的微观示意图( 和
和 表示两种质子数不同的原子)。
表示两种质子数不同的原子)。
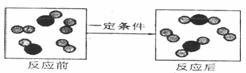
(1)该反应前后的原子种类是否发生变化? (填“是”或“否”);
(2)按物质分类的方法,在A、B、C三种物质中,属于化合物的是 ;
(3)该反应的化学方程式中,A、B、C的化学计量数之比为 。
23.(5分)车用乙醇汽油是将乙醇(C2H5OH)与汽油(以C8H18表示)按一定比例混合而成的一种汽车燃料。
(1)乙醇分子中,组成元素的原子个数比C:H:O为 。
(2)在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W。现测得反应前后各物质的质量如下:
物质
乙醇
氧气
二氧化碳
水蒸气
W
反应前质量/g
23
40
0
0
0
反应后质量/g
0
0
22
27
x
①根据质量守恒定律,得出表中x的值为 ;
②根据表中数据,可确定未知物W中各组成元素的质量比为 ;
(3)通常可燃物中碳元素质量分数越高,燃烧产生 W越多。则相同条件下,乙醇和汽油分别燃烧时,产生W较多的是 ;为了使乙醇汽油燃烧过程中少产生 W,应采取的措施是 (任写一种)。
24.(4分)下图是A、B、C三种固体物质(固体组成与溶质相同)的溶解度曲线。在t
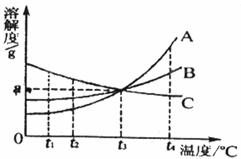
(1)三种物质中,随温度升高溶解度减小的物质是 ;
(2)t
(3)若使这三种溶液溶质的质量分数相等,则温度应由t
(4)若将温度由t
三、(本题包括2小题,共14分)
25.(6分)化学知识在生产、生活中有广泛的应用。
(1)“5?12”汶川大地震发生后,为了保证饮用水的安全卫生,灾区使用了某种净水消毒泡腾片,其有效成分是二氧化氯。二氧化氯的化学式为 ,其中氯元素的化合价为 。
(2)“水立方”是2008年北京奥运会的主游泳馆,它的墙体与屋面上紧密却不规则地排列着浅蓝色气泡。制作该气泡的材料是乙烯―四氟乙烯的聚合物(ETFE)膜材,它属于 材料(填“金属”或“有机合成”)。为确保“水立方”泳池的水质达到国际泳联最新卫生标准,将采用砂滤―臭氧―活性炭净水工艺净化泳池里的水,其中砂滤的作用是 ,臭氧的主要作用可能是 ,使用活性炭是利用它的 性。

26.(8分)下图转化关系中(其中部分产物已略去),A是一种难溶于水的碳酸盐;E是一种蓝色沉淀,受热分解后,得到金属氧化物和水;K是一种白色沉淀。请回答下列问题:
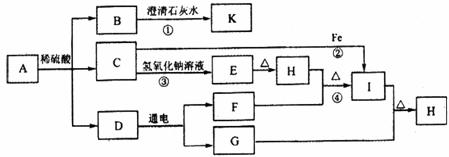
(1)A物质中所含金属阳离子的符号为 ,物质G的化学式为 ;
(2)指出下列反应所属的基本反应类型:③为 反应,④为 反应;
(3)写出下列反应的化学方程式:反应① ,反应② 。
四、(本题包括2小题,共20分)
27.(7分)以下是我们熟悉的实验室制取气体的发生装置、收集装置以及净化装置(装置⑦中碱石灰为固体氢氧化钠和氧化钙的混合物)。请根据装置图回答下列问题:
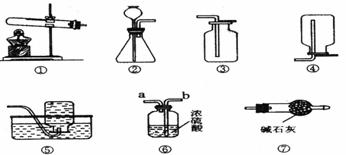
(1)将装置①中的固体加热时应先 ;若用装置⑥净化气体,则气体应从 端通入(填“a”或“b”)。
(2)实验室用过氧化氢溶液和二氧化锰制氧气,应选用的发生装置为 、收集装置为
(填装置的编号),过氧化氢溶液应从 中加入(填仪器名称),其中二氧化锰起 作用。
(3)实验室常用加热氯化铵与氢氧化钙固体混合物的方法制取氨气。通常情况下,氨气的密度比空气小且极易溶于水。若要制得干燥的氨气,则装置的连接顺序为 (填装置的编号)
28.(13分)某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
【查阅资料】(1)Ca(HCO3)2可溶于水;
(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水。
【猜想】(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液。
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别。
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
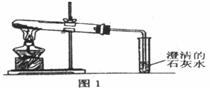
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的。
【问题讨论】(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图2、图3)。请写出Na2CO3与澄清石灰水发生反应的化学方程式 ;写出NaHCO3与澄清石灰水混合时参与反应的离子: 。
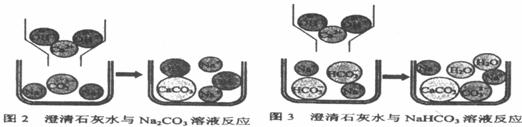
(2)乙同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,该反应的化学方程式为 ;而对CaCl2与NaHCO3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:
CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,因而同学们知道了乙同学是通过观察到
现象来鉴别Na2CO3和NaHCO3溶液的。
至于CaCl2与NaHCO3溶液为什么能发生上述反应,老师指出其反应原理较复杂,有待于今后学习中进一步探究。
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是 ;根据你分析:Na2CO3受热 分解(填“易”或“不易”)。在加热NaHCO3固体时,丙同学观察到的实验现象是
(任写一种)。
【拓展应用】(1)固体Na2CO3中混有少量NaHCO3,可通过 方法除去。
(2)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的 溶液。
五、(本题包括1小题,共7分)
29.(7分)国家规定,酿造食醋总酸含量不得低于3.
首先取10 mL该白醋样品,稀释至 100 mL;然后,取稀释后的溶液20 mL用溶质质量分数为0.4%的NaOH溶液中和,当消耗NaOH溶液
应)。
计算:(1)20mL稀释后的溶液中醋酸的质量;
(2)该市售白醋样品中的总酸含量,并说明是否符合国家标准。