2007-2008第一学期期中质量检测九年级化学试题
时间:90分钟 分值:100分
第Ⅰ卷(选择题 46分)
一、选择题(本题包括17小题,每小题只有1个选项符合题意。1―5小题每题2分,6―17小题每题3分,共46分。请将正确选项的序号填在下表中。)
1.用氯化钠配制
A.①②③④ B.⑤②④① C.①③⑤②④① D.①③⑥⑤②④①
2.亚硝酸钠(NaNO2)外观与食盐很相似,有咸味,误食易中毒。区别它们的一种方法是:隔绝空气加热。没有明显变化的是食盐。能分解放出有刺激性气味气体的是亚硝酸钠。此气体可能是
A.SO2 B.NO
3.下列叙述错误的是
A.实验室用CO与Fe2O3反应制取铁时,先点燃酒精灯,再通CO
B.篝火晚会时通常把木柴架空一些能使燃烧更旺
C.自行车支架上刷上油漆既美观又能防止钢铁生锈
D.利用洗涤剂的乳化功能可洗去餐具上的油污
4.如要将
A.
5.2007年我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关水的知识中,错误的是
A.水是一种最常见的溶剂,自然界中的水都含有杂质
B.含汞、镉、铅的电池会造成水和土壤的污染,所以应倡导废旧电池的统一回收处理
C.用煮沸或蒸馏的方法能降低水的硬度
D.水中Ca2+、Mg2+的增多会引起水体的富营养化
6.医院里常用溶质分数为5%的双氧水(H2O2)溶液清洗受伤病人的伤口,若要配制5%的双氧水溶液
A.
7.“绿箱子环保计划――废弃手机及配件回收联合行动”已在全国40个重点城市中开展了近两年。下列有关废弃手机中的金属材料回收利用的说法不正确的是
A.可以节约金属资源 B.可以节约冶炼相关金属所消耗的能源
C.可以减少对环境的污染 D.回收废弃手机中的金属材料没有任何价值
8.下列说法错误的是
A.氧化反应不一定要有氧气参加 B.化学反应的发生伴随着能量的变化
C.不锈钢比纯铁硬,抗腐蚀性比纯铁好
D.取A、B两种物质各
9.比较归纳是化学学习中常用的一种方法。以下是C、CH4、CO三种物质转化为CO2的转化关系,即:①C→CO2 ②CH4→CO2 ③CO→CO2,对它们的比较归纳正确的是
A.三种转化发生的都是化合反应
B.三种物质都只能跟氧气反应转化为二氧化碳
C.三种转化所有的生成物在常温下都是气体
D.三种物质都可以在点燃条件下转化为二氧化碳
10.将一定量的生铁投入盛有足量稀盐酸的烧杯中,完全反应后,发现烧杯底部留有黑色残渣,其主要成分是
A.纯铁 B.碳的单质 C.氯化亚铁 D.氧化铁
11.现欲将粗盐提纯,并用制得的精盐配制质量分数一定的氯化钠溶液。下列说法正确的是
A.粗盐溶解时,可边加粗盐边用玻璃棒搅拌加速溶解
B.蒸发滤液时,待蒸发皿中滤液蒸干停止加热
C.配制溶液需要经过计算、溶解、称量、装液等步骤
D.配制溶液时必备的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等
12.各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是
A.用汽油除去衣服上的油污 B.用餐具洗洁精清洗餐具上的油污
C.用水洗去盘子中的水果渣 D.用醋洗去水壶的水垢
13.晓晓同学需配制
A.在托盘上垫纸称量12gNaOH固体
B.称量时发现指针向右偏转,应调节游码使天平平衡
C.用100mL量筒量取88mL水
D.用药匙搅拌,加速NaOH溶解
14.下列与铁有关的说法正确的是
A.生铁和钢都是铁的合金 B.炼铁是把单质铁变成氧化铁的过程
C.铁制污水管道可常用废酸液冲洗 D.被腐蚀的铁制品属于不可回收垃圾
15.物质的用途与性质密切相关。下列说法不正确是
A.铜用于制导线,是由于铜有良好的导电性
B.氮气常用作保护气,是由于氮气的化学性质不活泼
C.二氧化碳用于灭火,是由于二氧化碳不可燃、不助燃且密度比空气大
D.铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁稳定
16.小红同学在家做“粗盐提纯”实验,对其做法的认识中,错误的是
A.将粗盐放入玻璃杯中加水溶解――粒子在不断运动
B.溶解时用筷子搅拌――加快溶解速度
C.用自制净水器过滤粗盐水――可将粗盐水变为纯净物
D.实验时不用一次性塑料杯或纸杯――保护环境要从身边小事做起
17.在配制10%NaCl溶液的过程中,导致溶液中NaCl质量分数小于10%的可能的原因是
①用量筒量取水时仰视读数 ②配制溶液时烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称量氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯
A.①②③④⑤ B.只有①②④⑤ C.只有①②③ D.只有②③④⑤
第Ⅱ卷(非选择题 54分)
二、填空与简答题(29分)
18、(6分)学好化学能使我们更好地认识各种现象,更合理地解决实际问题,更轻松地应对生活中可能出现的突发事件。
(1)常用洗洁精洗涤油污,因为洗洁精与油、水混合会产生_________作用;冬天常在汽车的水箱中加入少量乙二醇之类的化合物可以防止水箱中的水结冰,因为乙二醇溶于水后使溶液的凝固点_________。(填“升高”或“降低”)
(2)不同的铁制品所采取的铁的保护方法有所不同。如自行车的链条常采用______________的方法防锈,自行车的车身常采用__________________的方法防锈。
(3)不同的火灾所采取的灭火万式也有所不同。如扑灭火势凶猛、蔓延迅速的森林火灾时通常采取的方法是_____________________________________________;扑灭用电线路老化而引起的火灾时应先___________________________________________________,再进行灭火。
19、(11分)金属材料是现代生活和工业生产中应用极为普遍的一类物质。
(1)钛合金是21世纪的重要材料,具有熔点高、可塑性好、抗腐蚀性强、与人体有很好的“相容性”等优良性能。金属的下列用途:①用来做保险丝 ②用来制人造骨 ③用于制造船舶 ④用于制造航天飞机。其中与钛合金性能符合的是__________________(填序号)。
(2)铁是一种最主要的金属材料,实验室里用一氧化碳还原氧化铁得到铁,实验过程中,先通入一氧化碳目的是______________________________________________________。
炼铁厂常以焦炭、赤铁矿、空气等为主要原料炼铁,反应过程如下:
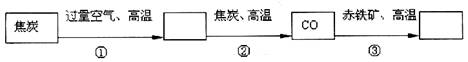
写出②③两步的化学方程式___________________________、__________________________、
(3)矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用。某兴趣小组同学欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,同收全部金属铜,应先加入_______,反应的化学方程式为:______________________、___________________________,充分反应后过滤,滤渣中含有_________。继续处理可以得到纯净的金属铜和硫酸亚铁固体。
(4)在学习了金属资源保护内容以后,兴趣小组同学对金属的锈蚀做了观察,发现残留水的铁锅在与水面接触的部位最易生锈;家用的铜质水龙头也生了一层绿色的铜锈。同忆已有的知识,铁生锈的原因是___________________________。那么铜生锈的原因是什么?查阅有关资料:铜锈的主要成份是Cu2(OH)2CO3。他们除依照铁钉锈蚀条件的探究方法进行实验外,还补充做了铜锈蚀与有关系的实验。请写出一种防止铁或铜等金属制品生锈的具体方法_____________________________________________。
20、(6分)实验室欲配制
(1)计算:需氢氧化钠固体_________g,水_________mL(水的密度是
(2)称量:用质量为
砝码/g
100
50
20
20
10
5
打“√”表示选用
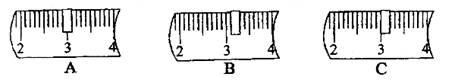
并在下列标尺中选出能正确表示游码位置的选项_________ (填字母).
(3)溶解:将氢氧化钠固体溶于水,用_________搅拌,使氢氧化钠全部溶解,冷却至室温。
(4)把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
21、(6分)已知A~G七种物质都是初中化学课本中出现过的化合物,其中F是常用的建筑材料;H为常见的单质。各物质之间存在如下转化关系(反应条件如下图所示)。

(1)请写出物质A的化学式___________________________。
上述蓝色溶液中的溶质有__________________、__________________。
(2)在①~⑥反应中属于化合反应的是__________________ (填序号)。
(3)上述转化过程中,有能够反映我国古代人民在化学方面对人类作出伟大贡献的变化。请举出其中一例,用化学方程式表示_____________________________________________。
三、实验探究题(16分)
22、(8分)某校化学研究性学习小组的同学在学习了《金属与矿物》一章后,做了如下图所示的探究实验。实验发现CO与CuO加热后黑色粉末变成红色粉末。请你参与该小组的研究过程并完成相关任务:
[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色CuO粉末:黑色,Cu2O粉末:红色
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:CuO十H2SO4=CuSO4+H2O
Cu2O+H2SO4=CuSO4+Cu+ H2O
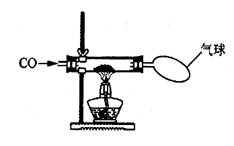
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测。
猜想
简单实验方案
现象
CO和CuO反应的化学方程式
(2)如果硬质玻璃管内红色粉末为两种物质的混合物,要确定粉末中两种物质的质量分数,还需要通过有关数据计算进行判断。下列数据不可作为计算依据的是( )
A.反应前CuO粉末的质量 B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量 D.反应后固体混合物的总质量
23、(8分)某研究性学习小组设计的实验装置(如右图),既可用于制取气体,又可用于验证物质性质。

(1)写出仪器A和B的名称:A:_________;B:_________
(2)当打开K1、关闭K2时,利用Ⅰ、ⅡI装置可直接进行的实验是(填序号)。
①大理石与稀盐酸反应制取二氧化碳 ②锌与稀硫酸反应制取氢气
小颖认为在不改变Ⅰ、Ⅱ装置的仪器及位置的前提下,该装置可用于双氧水制取氧气,她的做法是_____________________________________________;
实验室还可以用高锰酸钾制取氧气,化学方程式为________________________________。
(3)当打开K2、关闭K1时,利用Ⅰ、Ⅲ装置可验证二氧化碳与水反应,生成了碳酸,此时试管中盛放的物质是_____________,可以观察到的现象是_____________________________(C为干燥管,用于防止液体倒吸)。
四、计算题(9分)(相对原子质量H:1 Fe:56)
24、(9分)某化学兴趣小组用化学方法测定一种钢样品中铁的含量。同学们称取了
反应时间
L0
L1
L2
L3
烧杯和药品质量/g
25.7
25.6
25.5
25.5
(1)反应中产生氢气_________g,这种钢样品中铁的含量是多少?(精确到0.1%)
(2)钢的类型分为:含碳质量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢。假设残留在烧杯中的黑色固体全部是炭,则这种钢属于_________________。
(3)有同学提出:灼烧可使钢中的炭变为CO2挥发掉,灼烧后钢样品质量会减轻。可是他们将一定量的钢样品灼烧后,发现质量反而增加了很多。原因是_________________________。