山东省二OO七年中等学校招生考试
化 学 试 题
注意事项:
1.本试题分选择题和非选择题两部分。选择题16分,非选择题34分,共50分。考试时间为60分钟。
2.答卷前务必将密封线内的项目填写清楚。
3.答卷时一律用黑色、蓝色钢笔或圆珠笔。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ca 40
一、选择题:本大题包括8小题,每小题2分,共16分。在每小题所列的四个选项中,只有一项是最符合题意的。请将最符合题意的答案标号(ABCD)填写在第3页的答题栏内。
1.下列质量增加的变化有一种与其它三种存在本质的区别,这种变化是
A.长期放置在空气中的氢氧化钠质量增加
B.长期敞口放置的浓硫酸质量增加
C.久置的生石灰质量增加
D.久置的铁钉生锈质量增加
2.以下是一常用的危险品标志,装运乙醇的包装箱应贴的标志是

3.已知化学方程式X+2O2 CO2+2H2O,下列对X的判断不正确的是
CO2+2H2O,下列对X的判断不正确的是
A.X是一种最简单的有机化合物
B.一定含碳、氢、氧三种元素
C.X是一种重要的气体燃料
D.X的化学式是CH4
4.化学的研究目的就是帮助人们认识、改造和应用物质,把金属矿物冶炼成金属就是人们利用化学方法实现物质改造的典型范例。下表中不同的金属被开发和利用的年代不同,从化学反应的角度看,决定这一年代先后顺序的关键因素是
 |
A.金属的活动性 B.金属的导电性
C.金属的延展性 D.地壳中金属元素的含量
5.正确的化学实验操作对实验结果、人身安全非常重要。下图中的实验操作正确的是

6.20世纪20年代,就有人预言可能存在由4个氧原子组成的氧分子(O4),但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它的存在。下列叙述中正确的是
A.O4是一种新型的化合物 B.一个O4分子中含有2个O2分子
C.O4和O2的性质完全相同 D.O4和O2混合形成的是混合物
7.图表资料可以为我们提供很多信息,下列从图表中获取的信息及应用不正确的是
A.根据金属活动性顺序表,判断金属是否容易被盐酸腐蚀
B.根据金属的熔点数据表,判断金属的导电性强弱
C.根据溶解度曲线图,选择从溶液中获得晶体的方法
D.根据元素周期表,查找元素的原子序数、元素符号、相对原子质量
8.下列对一些事实的微观解释错误的是
事实
解释
A
食盐溶于水不溶于油
微粒间相互作用不同
B
炎热的夏天自行车胎容易爆裂
分子运到加快
C
水电解产生氢气和氧气
分子是可以再分的
D
架在高处的电线夏季变得比冬季长
原子的体积热胀冷缩
二、简答题:本大题包括7个小题,共34分。请用黑色、蓝色钢笔或圆珠笔将答案直接答在试卷上。
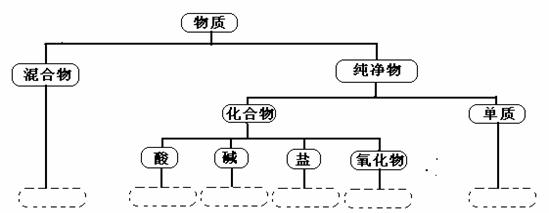
9.(5分)分数是学习和研究物质及其变化的一种常用方法。分数要有一定的标准,如果按照物质的组成对空气、氯酸钾、氮气、烧碱、二氧化锰五种物质进行分类,请将物质的分类结果填写在下面的虚线框内(要求纯净物用化学式表示)
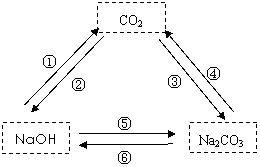 10.右图中给出了三种物质,根据物质的性质及化学
10.右图中给出了三种物质,根据物质的性质及化学
变化的规律,写出它们之间能够直接转化的反应的
化学方程式。
______________________________________
______________________________________
_______________________________________
_________________________________________
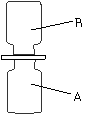 11.(5分)化学课上老师表演了一个小魔术――“无中生有”:相同条件下,
11.(5分)化学课上老师表演了一个小魔术――“无中生有”:相同条件下,
向A、B两个体积相同的集气瓶中分别充满无色的硫化氢(H2S)气体和二
氧化硫气体。如图所示,抽开毛玻璃片,瓶口对紧,颠倒几次,使两种
气体充分混合。一会儿,观察到两瓶内壁附着淡黄色固体颗粒。请回答
下列问题:


 (1)若用“ ”表示氢原子,用“ ”表示氧原子,用“ ”表示硫原子,上述反应过程可用下图表示:
(1)若用“ ”表示氢原子,用“ ”表示氧原子,用“ ”表示硫原子,上述反应过程可用下图表示:
 |
该反应的化学方程式为___________________________________________;
硫化氢、二氧化硫中硫元素的化合价分别为______________________。
(2)如果这两个瓶子是质地较软的塑料瓶,我们将会观察到塑料瓶变瘪了,原因是
______________________________________________________________________________。
(3)已知:相同条件下,相等体积的气体所含的分子数目相等。反应完毕,瓶中剩余的气体为____________,处理该气体的方法是_____________________________________。
12.(3分)
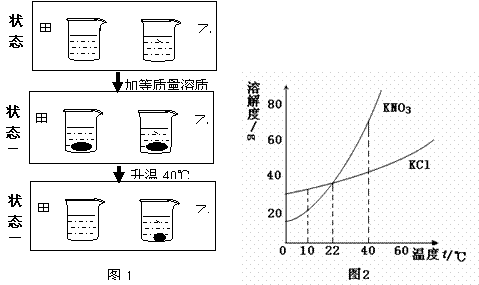 |
(1)当温度t的取值范围为________时,硝酸钾的溶解度大于氯化钾的溶解度。
(2)烧杯甲盛放的是___________溶液。
(3)状态三时,烧杯___________中溶剂水的质量相对较小。
13.(3分)把一小包铁粉放入一定量的硝酸铜溶液中,使其充分反应后,过滤、洗涤、干燥,得到固体。请你对固体的成分进行探究。
(1)猜想:固体的成分可能 是______________________________________。
(2)实验:请设计实验验证你的猜想。说明实验过程、现象和结论。
___________________________________________________________________________________________________________________________________________________________。
14.(6分)为了制备少量的氧气,某实验小组分三个阶段开展了一系列的工作:
第一阶段:查阅文献资料,获得了下列信息:双氧水、氯酸钾、高锰酸钾等含有氧元素的物质在一定的条件下分解都可以产生氧气。其中双氧水溶液价格最低,在常温下就能够分解放出氧气,该过程无副产物;氯酸钾价格较高,分解较困难,且常伴有副产物;高锰酸钾价格较高,加热即可快速分解。二氧化锰能加速上述三种物质的分解。
根据上述信息,选择双氧水溶液和二氧化锰混合制备氧气。
第二阶段:到实验室准备实验用品,安装实验仪器,进行制备实验。可供选择的实验装置如下:

第三阶段:实验完毕经,洗刷实验仪器,整理实验用品。
问题:
(1)要制取一瓶氧气,应选择的实验装置是_________________(填写字母代号):组装好实验装置后应首先进行____________________________________。
(2)有气体产生的化学反应在有限的空间里发生时,如果反应过快,容易引起爆炸,你认 为可以采取哪些措施预防爆炸?(列举两条)
___________________________________________________________________________________________________________________________________________________________。
(3)回顾整个工作过程,你认为在准备工作阶段除应考虑药品的价格、制氧反应的难易、制氧过程的安分性等问题外,还应考虑哪些问题?(至少列举两条)
_______________________________________________________________________________________________________________________________________________________。
15.(5分)某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品
序号
加入稀盐酸的质量/g
剩余固体的质量/g
第1次
20
11
第2次
20
6
第3次
20
2.8
第4次
20
n
(1)上表中n的数值为___________。
(2)样品中碳酸钙的质量分数是____________。
(3)求盐酸中溶质的质量分数。