2007年聊城市阳谷县中考模拟考试化学试卷
(时间:50分钟 满分50分)
说明:1.本试题由第Ⅰ卷、第Ⅱ卷和答题卷三部分组成,考试结束后,只收答题卡和答题卷;
2.考生把第Ⅰ卷答案字母用2B铅笔涂在答题卡上。把第Ⅱ卷答案写在答题卷上。
相对原子质量:H:l C:12 O:16 Na:23 Cl:35.5
第Ⅰ卷(选择题,共20分)
一、选择题:(本题包括10个小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.生活中许多物质的变化常常伴随着能量改变,下列放热现象主要是由物理变化引起的是( )
A.液化气燃烧放热 B.生石灰与水反应放热
C.电暖气通电发热 D.食物腐烂发热
2.据报道,推广车用乙醇汽油可改善机动车燃油问题。已知乙醇的化学式为C2H5OH,下列说法中不正确的是( )
A.乙醇是一种化合物
B.乙醇由碳、氢、氧三种元素组成
C.一个乙醇分子共含有9个原子
D.C、H、O元素的质量比是2:6:1
3.下列化学物质与人的生命活动有关的叙述中,不正确的是( )
A.糖类是人类食物中主要的供能物质
B.夏天出汗多,要及时补充食盐和水,以调节体液平衡
C.一氧化碳会与血液中的血红蛋白结合,使人中毒
D.人体中缺乏钙、铁、碘元素会引起许多疾病,所以饮食中摄入得越多越好
4.烧杯是常用的实验仪器。下列实验中需要使用烧杯的是( )
①稀释浓硫酸 ②用过氧化氢制取氧气
③用固体药品配制一定溶质质量分数的溶液 ④过滤
A.①③ B.①③④ C.①④ D.①②③④
5.
A.水电解可生成H2和O2,说明水是由氢元素和氧元素组成的
B.PH<5.6的酸性降水称为酸雨,它的形成与大气中的SO2等酸性污染物有关
C.水中Ca2+Mg2+的增多会引起水体的富营养化污染,形成“水华”和“赤潮”
D.在水溶液中发生的反应一般速率快而且充分
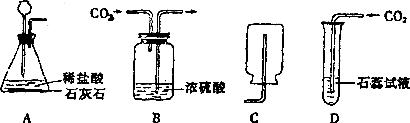
6.下列所示分别是二氧化碳的制取、干燥、收集和性质检验的装置图,其中正确是( )
7.将下列各组内的物质混合,充分反应后过滤,所得溶液的质量比反应前溶液质量减少的是( )
A.Zn和稀盐酸 B.Cu(OH)2和稀硫酸
C.Cu和AgNO3溶液 D.Na2CO3固体和稀盐酸
8.下面是某同学设计的实验方案,你认为不可行的是( )
A.按溶解、过滤、蒸发的操作顺序可以分离NaCl和CaCO3的混合物
B.向某未知溶液中加入AgNO3溶液,产生白色沉淀,证明溶液是盐酸
C.除去氯化钾溶液中的氯化钙杂质,先加入适量碳酸钾溶液,再过滤
D.确定某溶液中是否含有铵根离子,可先向该溶液中滴加氢氧化钠溶液,并加热,若有刺激性气味的气体产生,且该气体能使红色石蕊试纸变蓝,则证明原溶液中含有NH4+
9.下列物质的水溶液,跟Fe2O3、Fe、Ca(OH)2溶液、AgNO3溶液都能反应的是( )
A.CuSO4 B.HCl C.Na2CO3 D.HNO3
10.下列图像不能正确反映其对应操作的是( )
A
B
C
D
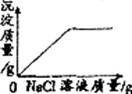


在一定量AgNO3溶液中逐滴加入NaCl溶液
等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应
向NaOH溶液中逐滴加入稀盐酸
等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应
第Ⅱ卷(非选择题,30分)
二、填空与简答题:(本题包括4小题。共16分)
11.(3分)化学就在我们身边,它能改善我们的生活。请从“A.干冰;B.氢气;C.尿素;D.明矾;E.蛋白质;F.硝酸钾;G.石油;H.纯碱;I.烧碱”中选择适当的物质填空(填字母)。
(1)常用于净水的物质是 ;
(2)被誉为“工业的血液”的是 ;
(3)构成人体细胞的基础物质是 ;
(4)农业上可用作复合肥的是 ;
(5)被称为理想“绿色能源”的是 ;
(6)侯氏联合制碱法中的“碱”是 。
12.(4分)对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强.常温下,10%的稀硫酸的pH (填“大于”“小于”或“等于”)2%的稀硫酸的pH。如果要使10%的稀硫酸的pH升高,可采取如下方法:
(1)发生化学反应的方法:可以加入的物质是(要求物质的类别不同) 、 。
(2)不发生化学反应的方法是 。
13.(3分)苯甲酸是一种食品防腐剂,它是一种片状晶体,在水中的溶解度如下表所示:
温度
溶解度
0.
0.
6.
某同学为了提纯苯甲酸样品(其中含泥沙等难溶于水的杂质),进行了如下实验:
(1)取样品约
(2)将烧杯放在石棉网上加热,待样品充分溶解后,再加少量蒸馏水,然后趁热过滤。趁热过滤的目的是 。
(3)将所得滤液 ,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体。
14.(6分)某中学组织了一次识别化肥的探究活动:他们从家中拿来了五种化肥,分别是硫酸钾、氯化钾、碳酸氢铵、氯化铵和硝酸铵。
第一步:称取五种化肥各
第二步:取少量上述化肥。能直接闻到气味的是 ;
分别加入少量熟石灰粉末,混合研磨,能嗅到气味的另两种盐分别是:
① ②
第三步:请你完成硝酸铵与氯化铵的鉴别 。
第四步:另取两种钾盐各少量分别盛于两支试管中配成溶液,再分别滴入几滴氯化钡溶液,生成白色沉淀的钾盐是 。
三、实验题:(本题共8分)
15.(8分)钠的氧化物通常有氧化钠(Na2O)和过氧化钠(Na2O2)。Na2O是白色固体,Na2O2是淡黄色固体。Na2O2中常混有少量Na2O,化学兴趣小组的同学欲测定某试样中Na2O2的纯度,请你和他们一起完成实验:
(1)我们已经知道:Na2O+H2O=2NaOH;请完成Na2O2与H2O反应的化学方程式:2Na2O2+2H2O=4NaOH+ ↑,检验该气体可用 。
(2)该兴趣小组的同学设计了甲、乙两套装置:
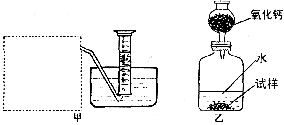
甲装置中虚线方框内为气体发生装置,你认为应和实验室制取 的装置相同。该兴趣小组选择这种方法收集气体的依据是 ,你认为还可以用 法收集。
(3)乙装置用来测定生成气体的 。
(4)甲装置用来测定生成气体的 (标准状况下)。若知道试样的质量,要想求出Na2O2的纯度,还需要知道的数据有 。
A.气体在标准状况下的密度 B.反应装置中加入水的质量
C.反应后溶液的质量
四、计算题:(本题共6分)
16.某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。为了测定该产品中含碳酸钠的质量分数,进行了以下实验:取11.
所加盐酸的次数
第一次
第二次
第三次
第四次
烧杯及所盛物质的总质量/g
181.2
204.4
228.6
253.6
请你据此分析计算:
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是 g。
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%。