2006-2007学年度第二学期期中考试八年级
化学试卷
(时间:40分钟 满分:100分)
可能用到的相对原子质量:H―1,C―12,N―14,0―16,S―32,Cl―35.5,Ca―40,Zn―65。
一、选择题:(四选一,请把正确答案的序号填在下表内,每小题3分,共45分)
1.下列观点中正确的是( )
A.通过化学变化一定能改变物质的性质
B.改变物质的性质一定要通过化学变化
C.在化学变化中原子中的电子数不会发生改变
D.在任何变化中原子核都不会发生改变
2.每年的
A.青少年应该远离毒品
B.K粉是纯净物
C.盐酸氯胺酮由五种元素组成
D.盐酸氯胺酮中氢元素与氧元素的质量分数相同
3.实验室制取氧气时,必须满足的条件是( )
A.必须使用催化剂 B.必须用含氧元素的物质作反应物
C.必须用排水法收集 D.必须用燃着的火柴检验是否收集满
4.下列有关金属和金属材料的说法不正确的是( )
A.铁有良好的导热性,常用来制作炊具
B.铜的化学性质不活泼,在潮湿的空气中不会生锈
C.废旧电池中汞的回收可减少对环境的污染
D.铝表面易形成致密的氧化膜可阻止铝进一步被氧化
5.黑龙江省齐齐哈尔市第二制药有限公司生产、销售假药案件,造成了多人死亡的严重后果。而该公司生产的“亮菌甲素注射液”等假药的原料即来自于江苏泰兴化工总厂的假“丙二醇”。其真丙二醇的化学式为C3H8O2,下列说法正确的是( )
A.丙二醇中碳、氢、氧元素的质量比为3:8:2
B.丙二醇的相对分子质量是76
C.丙二醇充分燃烧的生成物只有二氧化碳
D.丙二醇分子中含有13种元素
6.下列化学用语中,正确的是( )
A.2个氮分子――2N
B.氢氧化铁的化学式――Fe(OH)3
C.H2O2中氧元素的化合价为―2价
D.加热高锰酸钾和二氧化锰混合物制氧气的化学方程式:2KClO3==2KCl十3O2↑
7.某物质R与水和氧气发生化学反应为:2R+2H2O+7O2==2FeSO4+2H2SO4,推断R的化学式为( )
A.FeS B.Fe2S
8.为了揭开原子内部结构的奥秘,1911年著名物理学家卢瑟福等人做了一个著名的“卢瑟福实验”:用一束带正电的质量比电子大很多的高速运动的a粒子轰击金箔,结果是大多数a粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,甚至有极少数的a粒子被反弹了回来。通过这一实验现象不能够获得的结论是( )
A.原子核质量较大 B.原子核体积很小
C.核外电子带有负电荷 D.原子核带有正电荷
9.下列实验操作你认为合理的是( )
A实验后的废弃液要及时倒入下水道
B.实验室制氧气的实验完毕,立即熄灭酒精灯,再将导管从水中移出
C.给试管里的固体加热,试管离焰心越近越好
D.过滤操作时,滤纸边缘低于漏斗边缘
10.古诗词是古人留给我们的宝贵精神财富。下列诗词中不涉及化学变化的是( )
A.春蚕到死丝方尽,蜡炬成灰泪始干 B.千锤万凿出深山,烈火焚烧若等闲
C.爆竹声中一岁除,春风送暖入屠苏 D.好雨知时节,当春乃发生
11.几种物质的化学式及其名称分别是:硫代硫酸钠Na2SO3、多硫化钙CaSx、过氧化钡BaO2。根据上述命名规律,K2CS3的名称是( )
A.三硫代碳酸钾 B.多硫碳化钾 C.过硫碳酸钾 D.超硫碳酸钾
12.用一块棉布手帕浸泡在质量分数为70%的酒精中,待均匀湿透后取出。用镊子夹住两角展开,用火点燃,当手帕上的火焰熄灭后,手帕完好无损。对于这一现象,下列解释正确的是( )
A.这是魔术,你看到的是一种假象
B.火焰的温度低于棉布的着火点
C.手帕上的水和酒精汽化吸热,使手帕的温度低于棉布的着火点
D.酒精燃烧后使棉布的着火点升高
13.超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox,假设在研磨烧结过程中各元素的化合价无变化,则x的值为( )
A.12 B.
14.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下
物质
A
B
C
D
反应前质量(g)
19.7
8.7
31.6
0.4
反应后质量(g)
待测
17.4
0
3.6
下列说法错误的是( )
A.C一定是化合物,D可能是单质
B.C物质中元素的种类,一定等于A、B、D三种物质中元素的种类
C.反应过程中,物质B与物质D变化的质量比为87:36
D.若物质A与物质C的相对分子质量之比为197:158,则反应中A与C的化学计量数之比为1:2
15.在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是( )
A.10% B.25% C.30% D.35%
二、填空题(共6小题,共36分)
16.(8分)施兰同学在探究常见金属的活动性顺序后,明确了A、B、C三种金属在常见金属的活动性顺序表中的位置如下,请回答下列问题:
Mg Al A Fe Pb(H) B Hg C Au
――――――――――――――――――→
金属活动性由强到弱
(1)在A、B、C三种金属中,能与稀盐酸发生反应的是________,最不活泼的是________。
(2)若B是铜,则下列有关的化学方程式书写正确的是__________(填序号)
a.Cu+MgSO4==CuSO4+Mg b.Fe+CuSO4==FeSO4+Cu
(3)在学习和日常生活中,铁的金属活动性比金强的事例不少,请你举一例加以说明:
__________________________________________________________________________
17.(8分)化学反应方程式是重要的化学用语,请分别写出一个符合要求的化学方程式。
(1)有二氧化碳生成的分解反应_________________________________________________;
(2)有水生成的化合反应________________________________________________;
(3)有氢气生成的置换反应______________________________________________;
(4)某同学发现养鱼师傅向鱼塘中撒一种微黄色的固体,咨询得知,这种固体的主要成分是过氧化钙(CaO2),是为了解决鱼塘中氧气不足的问题。他回家后查阅资料,查到过氧化钠与水反应的原理:2Na2O2+2H2O==4NaOH+O2↑,且CaO2与Na2O2的化学性质非常相似。请写出CaO2与2H2O反应的化学方程式________________________________________。
18.(4分)流感发生时,可用醋对室内空气进行消毒,为了迅速增加室内空气中醋的含量,常采用给醋加热的方法。
(1)通过对上述事例的分析,关于温度与分子运动速率的关系你能得出什么结论?
____________________________________________________________________________
(2)请你从生活或生产实际中,再举出一个符合上述结论的事例。
19.(3分)美国“勇气”号火星探测器成功登陆火星,使人类对火星的研究进入了新阶段。现在已测知,火星大气层上方无臭氧层,大气中95%为CO2,O2和H2O的含量极少。火星目前还不适宜人类生存的理由是(写3点)①_______________________________________;②______________________________________;③___________________________________。
20.(5分)锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会引起多种疾病,因此缺锌者可通过服用葡萄糖酸锌等保健品来补锌。已知葡萄糖酸锌的化学式为C12H22O14Zn。请回答:
(1)葡萄糖酸锌是由__________种元素组成的。
(2)葡萄糖酸锌中所含锌元素的质量分数为___________(结果保留至0.1%)。
(3)现有一支20mL的葡萄糖酸锌口服液,其中含锌6.5mg,那么该口服液中葡萄糖酸锌的质量是____________mg。
21.(8分)人类的生产和生活都离不开燃料。下面是人类大规模使用燃料的大致顺序:木柴→木炭→煤→石油、天然气。
(1)上述燃料中属于化石燃料的是__________________。这些化石燃料属于____________(“纯净物”或“混合物”),其中通常被称为“清洁能源”的是_______________________。
(2)天然气(主要成分为CH4)完全燃烧的化学方程式为:___________________________。
三、实验题(14分)
22.(14分)下图所示为实验室常用的实验装置:
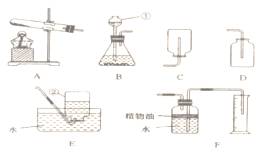
据此回答下列问题
(1)写出带标号仪器的名称:①______________,②__________________;
(2)常温下,用锌和稀硫酸反应制取氢气应选用的发生装置是________________(填序号,下同),收集装置是________________________;
(3)实验室通常用稀盐酸和石灰石反映制取二氧化碳,该反应的化学方程式为____________;此外,二氧化氮也可以用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为___________________________________________。若用此法来制取二氧化碳,应选用的发生装置是______________,收集装置是________________;
(4)F装置可用来测量生成的二氧化碳气体的体积,其中在水面上放一层植物油的目的是_________________,植物油上方原有的空气对实验结果___________(填“有”或“没有”)明显影响。
四、计算题(5分)
23.煤是一种化石燃料,用煤作燃料生成的SO2气体会造成环境污染。有一种煤每燃烧1t就会释放出