2007年济宁市嘉祥县中考模拟考试
化学试卷(二)
相对原子质量:C:12 H:1 O:16 S:32 Cl:35.5 Zn:65
一、选择题(下列各题只有一个正确选项,请把正确选项的序号填写在题后的括号内。1―4题各1分,5―10题各2分,共16分)
1.人类使用材料的历史,就是人类利用物质的进步史。制造下列用品所需的材料不是通过化学变化获取的是 ( )
A.石器 B.青铜器 C.铁器 塑料器具
2.每年的
A.青少年应该远离毒品
B.K粉是纯净物
C.盐酸氯胺酮由五种元素组成
D.盐酸氯胺酮中氢元素和氧元素的质量分数相同
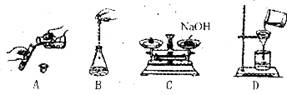
3.下列实验基本操作正确的是 ( )
4.类推是化学学习中常用的思维方法。现有以下类推结果:
①酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应;
②碱的水溶液显碱性,所以碱性溶液一定是碱溶液;
③氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物;
④有机物都含碳元素,所以含碳元素的化合物都是有机物。其中错误的是 ( )
A.只有① B.只有①②③
C.只有②③④ D.全部
5.为了揭开原子内部结构的奥秘,1911年著名物理学家卢瑟福等人做了一个著名的“卢瑟福实验”:用一束带正电的质量比电子大很多的高速运动的a粒子轰击金箔,结果是大多数a粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,甚至有极少数的a粒子被反弹了回来。通过这一实验现象不能够获得的结论是 ( )
A.原子核质量较大 B.原子核体积很小
C.核外电子带有负电荷 D.原子核带有正电荷
6.物质X是一种重要的阻燃剂。工业上用三氧化二锑(Sb2O3)生产X的化学方程式为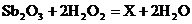 。根据质量守恒定律,推断X的化学式为 (
)
。根据质量守恒定律,推断X的化学式为 (
)
A.SbO2 B.Sb2O
7.为检验某化合物是否由碳、氢、氧三种元素组成,取一定质量的该化合物在氧气中充分燃烧后,还须进行的实验有 ( )
①用带火星木条检验O2 ②用无水硫酸铜检验H2O
③用澄清石灰水检验CO2 ④测定生成物的质量
A.①②③④ B.①②③ C.②③④ D.②③
8.在生活、生产和科学实验中,要除去混合物中的杂质,通常有两种思路:①将杂质从混合物中除去;②将有用物质从混合物中取出。以下除去混合物中杂质的方法中,与②的思路一致的是 ( )
(1)已知液态氧和液态氮的沸点分别是一
(2)实验室用蒸馏的方法制取蒸馏水。
(3)海盐厂以海水为原料,用太阳能蒸发法晒得粗盐。
A.(1) B.(2) C.(1)(2) D.(2)(3)
9.按酸、碱、盐、氧化物的顺序排列的一组物质是 ( )
A.H2SO4、Na2CO3、NaCl、CuO
B.H2O、Ca(OH)2、HCl、Na2SO4
C.H2SO4、NaOH、Na2CO3、Fe2O3
D.NaOH、H2CO3、NaCl、CO2
10.将一定量铝粉和氧化铜混合加热,反应的化学方程式为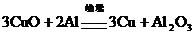 。反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是 ( )
。反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是 ( )
①加入稀硫酸后,有气泡生成
②加入稀硫酸后,没有气泡生成
③加入稀硫酸后,溶液中有红色不溶物质
④插入溶液中的铁片表面有红色物质析出
A.只有④ B.②③ C.③④ D.①③④
二、填空题:(共16分)
11.制取调味品味精的主要原料是谷氨酸,谷氨酸的化学式为C5H9O4N,它由__________种元素组成,其中C、H、O、N原子个数比为__________。
12.我们在初中化学里学过的一些物质,在实际生活中有着重要的用途。请从①不锈钢 ②甲烷 ③活性炭 ④食盐 ⑤大理石中,选择适当的物质填空(填序号)。
(1)可用作冰箱除臭剂的是_____________;
(2)可用于制造刀具的是_____________;
(3)天然气的主要成分是_____________;
(4)可用作食品调味剂的是_____________;
(5)常用作建筑材料的是_____________;
13.请从H、O、Na、Cl中选择合适的元素,按下列要求写出相应物质的化学式(各写一例)
(1)最常用的溶剂_____________。
(2)可用于钢铁表面除锈的酸_____________。
(3)可溶于水的碱_____________。
14.写出下列反应的化学方程式,并指出其基本反应类型。
(1)磷在氧气中燃烧:_________________________________________________( )
(2)加热高锰酸钾制氧气:_____________________________________________( )
(3)将铁片放入硫酸铜溶液中:__________________________________________( )
15.某化工厂排出的废水透明、澄清且略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀HNO3的白色沉淀生成。过滤,将所得的滤液分成两份,一份滤液中加入稀H2SO4,也有不溶于稀HNO3的白色沉淀生成;另一份滤液中加入NaOH溶液,产生蓝色沉淀。试回答:
(1)用化学式回答:加入过量的盐酸,生成的白色沉淀是_____________;生成的蓝色沉淀是_____________。
(2)废水中一定含有的物质是_____________(填编号):
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验,方案如下[已知白色的Fe(OH)2]固体在潮湿的空气中可生成红褐色的Fe(OH)3]:
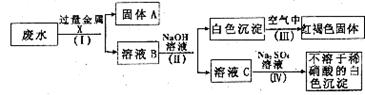
①金属X为_____________,固体A中一定含有的物质为(写化学式) _____________。
②B溶液中的溶质一定含有_____________和_____________ (填序号字母)。
A.K2CO3 B.Fe(NO3)
③第Ⅳ步反应的化学方程式为:__________________________________________________。
16.从HCl、NaCI、NaOH、Na2CO3、Ca(OH)2几种溶液中取出其中的两种混合,可能的组合共有_____________种。
(1)若混合后溶液质量减小,可能的组合是_____________、_____________。
(2)若混合后溶液质量不变,但发生了化学反应,有关的化学方程式为:
______________________________________________________________________________
______________________________________________________________________________
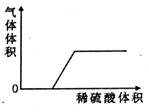
(3)将稀硫酸逐滴滴入剩下的几种组合中,若产生气体与加入稀硫酸有如下图所示的关系,则这样的组合可能是____________________________________________________。
三、实验题(12分)
17.某实验小组利用饱和澄清石灰水和碳酸钠溶液制取少量氢氧化钠溶液,反应后将浑浊液过滤,得到无色透明的滤液。请你设计实验检验滤液中除含氢氧化钠外,是否还有未反应完的反应物(检验一种物质即可)。
你想检验的物质
选用的试剂
可能观察到的实验现象
结论
18. 某实验小组同学在用下图甲和乙装置做木炭还原氧化铜的实验中,发现从乙装置的导气管口不断有气泡逸出,以为是反应产生的CO2未被石灰水完全吸收。于是在乙装置后又连接上丙装置,重新实验,发现丙装置中仍不断有气泡逸出,且石灰水未见浑浊。那么从丙装置中逸出的气体是什么呢?请完成下列探究中的有关问题。
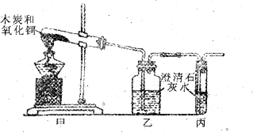
(1)你认为从丙装置中逸出的气体可能是_____________,写出生成这种气体的化学方程式:
__________________________________________________________________________。
(2)请按下列要求,设计实验方案,验证你的猜想。
操作步骤
现象
结论
①收集一小试管气体,______
____________________
从丙装置中逸出的气
体是______________。
②________________________
____________________
(3)写出乙装置中反应的化学方程式:_______________________________________。
(4)根据以上探究,该实验小组同学认为上述装置还不够完善,其理由是_________________
____________________________________________________;于是他们在丙装置后再增加一个_____________装置,例如:_______________________________________。
四、计算题(共6分)
19.将
(1)锌粒中纯锌的质量;
(2)稀硫酸中溶质的质量分数。
20.某实验小组为了测定人体呼出的气体中CO2的体积分数,设计如下实验:
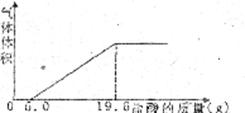
(1)收集
(1)加入
__________________________________________。
(2)加入盐酸产生CO2的总质量是多少(溶于水中的二氧化碳不计)?
(3)该气体样品中CO2的体积分数是多少?(精确到0.1%。已知:常温下CO2密度为1.