2006-2007学年度济南市槐荫区第一学期期末考试
九年级化学
可能用到的相对原子质量:H―1 C―12 N―14 O―16 Na―23 Mg―24 Al―27 S―32 Cl―35.5 Ca--40 Fe―56 Zn―65
一、选择题(本题包括20小题。共40分。每小题只有一个选项符合题意,将各题选出的答案序号填写在下表内,多选、错选、不选-该小题不得分)
1.空气的成分中体积分数最多的是
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
2.下列生活中的变化,属于化学变化的是
A.米饭变馊
B.电灯发光
C.湿衣服晾干
D.水结成冰
3.科学实验测定,正常情况下人类头发的化学组成为:45%的碳、28%的氧、15%的氮、7%的氢和5%的硫等。这里的碳、氧、氮、氢、硫泛指:
A.原子 B.分子 C.元素 D.单质
4.下列常见的物质中,属于纯净物的是
A.汽水 B.澄清石灰水 C.碘盐 D.过氧化氢
5.小红在餐厅看到服务员用盖子熄灭酒精火锅,该灭火方法的主要原理是
A.清除可燃物
B.隔绝空气
C.降低可燃物着火点
D.使可燃物的温度降到着火点以下
6.下列有关实验基本操作或有关实验现象的描述错误的是
A.点燃可燃性气体前,先检验气体的纯度
B.铁丝在氧气中燃烧时,火星四射,有黑色固体生成
C.向试管内滴加液体时,将胶头滴管伸入试管内
D.打开盛放浓盐酸的试剂瓶瓶口,会产生白雾
7.物质的性质决定它的用途,还决定其保存方法:固体KOH具有以下性质:
①白色固体
②有腐蚀性
③易吸收水分而潮解
④能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是
A.①② B.③④ C.①③ D.②④
8.下列说法不正确的是
A.物质发生化学变化,则元素种类、分子和原子都发生了变化
B.与元素的化学性质关系最密切的是原子的最外层电子数
C.保持水的化学性质的最小粒子是水分子
D.构成物质的分子问有问隔,且分子在不断地运动着
9.下列粒子的结构示意图中,表示同种元素的粒子的是

A.①② B.①②③ C.①④ D.③④
10.若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则
A.溶液的质量一定变小
B.溶液中溶质量分数一定变大
C.溶液的质量一定变大
D.溶液中溶质的质量分数可能不变
11.下列化学用语与含义相符的是
A.2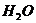 ――2个水分予子
――2个水分予子
B.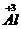 ――1个铝离子带3个单位正电荷
――1个铝离子带3个单位正电荷
C.2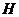 ――1个氢分子由2个氢原子构成
――1个氢分子由2个氢原子构成
D.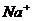 ――钠元素的化合价为+l价
――钠元素的化合价为+l价
12.有三瓶无标签的无色溶液,只知道它们分别是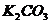 溶液、
溶液、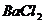 溶液和
溶液和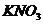 溶液中的各一种。下列四种试液中,能将三种无色溶液一次鉴别开来的是
溶液中的各一种。下列四种试液中,能将三种无色溶液一次鉴别开来的是
A.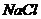 溶液 B.
溶液 B.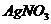 溶液 C.稀盐酸 D.稀硫酸
溶液 C.稀盐酸 D.稀硫酸
13.节日时燃放含有硝酸铜的烟花,可产生美丽的绿色火焰,发生的化学反应如下: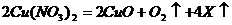 ,根据质量守恒定律推断,X的化学式为
,根据质量守恒定律推断,X的化学式为
A.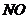 B.
B.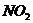 C.
C. D.
D.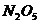
14.将甲、乙两种金属片分别放人硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象。据此判断,三种金属的金属活动性顺序是
A.甲>铜>乙 B.乙>铜>甲 C.铜>甲>乙 D.甲>乙>铜
15.下列物质按酸、碱、盐的顺序排列的是
A.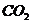
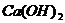
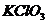
B.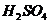
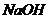
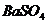
C.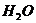
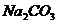
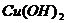
D.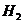
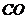

16.下列反应的化学方程式书写正确的是
A.铁在氧气中燃烧: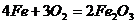
B.铁和稀盐酸反应: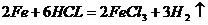
C.实验室制氧气: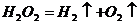
D.氢氧化钠溶液和稀硫酸反应: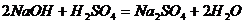
17.下图是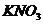 和
和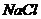 的溶解度曲线。下列说法中,不正确的是
的溶解度曲线。下列说法中,不正确的是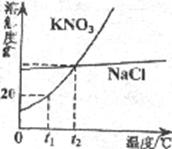
A.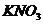 的溶解度受温度的影响比
的溶解度受温度的影响比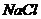 大
大
B.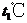 时,100g
时,100g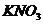 饱和溶液中含有20g
饱和溶液中含有20g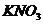
C.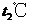 时,
时,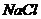 饱和溶液与
饱和溶液与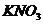 饱和溶液中溶质的质量分数相同
饱和溶液中溶质的质量分数相同
D.温度高于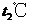 时,
时,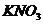 的溶解度大于
的溶解度大于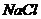 的溶解度
的溶解度
18.下列除杂(括号内的是杂质)所选试剂合理的是
A.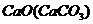 水
水
B.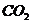 气体
气体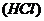 氢氧化钠溶液
氢氧化钠溶液
C.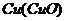 稀硫酸
稀硫酸
D.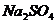 溶液
溶液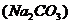 氯化钡溶液
氯化钡溶液
19.下列四个图像,分别对应四种操作过程,其中正确的是
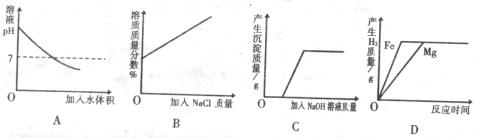
A.向氢氧化钠溶液中加入足量水稀释
B.某温度下,向接近饱和的氯化钠溶液中加入氯化钠晶体
C.向氯化铁和盐酸的混合溶液中加入过量氢氧化钠溶液
D.向两份同体积和相同质量分数的盐酸溶液中分别加入足量的铁糊和镁粉
20.分别将下列各组物质同时加到水中,得到无色、透明溶液的是 A.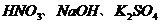
B.
C.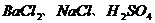
D.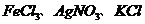
二、填空题(本大题包括7个小题,共30分)
1.从Fe、Cu、C、H、O、S六种元素中选择一种或几种元素按要求填空。
(1)用适当的数字和符号填空:
①三个氧原子______________; ②一种二价离子_____________;
③两个氨氧根离子__________; ④二氧化碳中碳显+4价_______。
(2)写出符合下列要求的物质的化学式:
①最常用的溶剂______
②在空气中体积分数占2l%的气体____________
③天然气的主要成分______
④能形成硫酸型酸雨的空气污染物_________
(3)用它们中一种或几种元素组成的物质各写出一个符合要求的化学方程式:
①化合反应_______________________________________________________
④复分解反应_____________________________________________________
2.在原子中:原子的质量主要集中在_________上;带有负电荷的微粒是_________。
3.要增大某溶液中溶质的质量分数,常采用的方法是:
(1) _____________________;
(2) __________________;
(3) _____________________。
4.苏丹红是一种人工合成的红色染料,最新研究表明,其体内代谢产物有强致突变性和致癌性,国家正在严查加有苏丹红的食品。它有几种类型,其中最常见的一种苏丹红的化学式为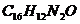 。试计算:
。试计算:
(1)该物质是由_________种元素组成,其分子中碳、氢原子个数比是____________。
(2)苏丹红中碳、氢、氧元素的质量比为_______________。(最简整数比)
(3)苏丹红中氮元素的质量分数是__________________。(结果精确至0.1%)
5.A、B、C、D四个烧杯分别盛有50g水,在相同的温度下,向四个烧杯中依次加入27g、9g、36g、18g的同种物质,充分溶解后的情况如下图所示。经观察后回答下列问题:
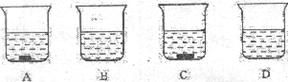
(1) _______________一烧杯中盛有的一定是不饱和溶液。
(2)保持温度不变,如果将A、B烧杯中的物质混合后,溶液恰好达到饱和,则该物质的饱和溶液中溶质的质量分数是_______________。(结果精确至0.1%)
6.将100g溶质的质量分数为20%的氢氧化钠溶液稀释成10%的溶液,需加水________g。
7.已知反应:A+B→C。若将7gA和2gB或4gA和7gB混合,在一定条件下充分反应后,均可以得到6gC。若A和B的混合物9g,充分反应后得到7.5gC,则此混合物中A的质量可能是_________g或_____________g。
三、实验和推断题(本大题包括2个小题。共19分)
1.某班同学在实验室选用下列装置进行二氧化碳气体的制取和验证性质的分组实验。
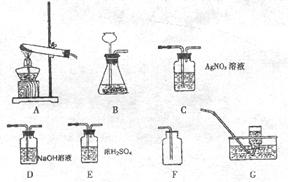
(1)实验室制取 气体应选择的气体发生装置是(填序号)
_______________;制取气体前应先检查装置的____________;常用_______________和大理石反应制取二氧化碳气体,该反应的化学方程式_________________________________。
气体应选择的气体发生装置是(填序号)
_______________;制取气体前应先检查装置的____________;常用_______________和大理石反应制取二氧化碳气体,该反应的化学方程式_________________________________。
(2)实验室收集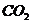 气体应选择的装置是(填序号)
__________;若要得到干燥的二氧化碳气体可将气体先通过装置(填序号)
__________再收集;检验二氧化碳气体是否已充满集气瓶的方法是_________________________。
气体应选择的装置是(填序号)
__________;若要得到干燥的二氧化碳气体可将气体先通过装置(填序号)
__________再收集;检验二氧化碳气体是否已充满集气瓶的方法是_________________________。
(3)为了探究制得的二氧化碳气体的性质,他们将二氧化碳气体通人足量澄清石灰水中,甲组同学观察到有白色沉淀产生,该反应的化学方程式_________________________。乙组同学却未观察到浑浊现象,他们猜想可能是错用了较浓的盐酸造成的结果,用化学方程式解释原因___________________。如果确实是错用了较浓的盐酸造成的结果,乙组同学应该选择__________装置与发生装置连接来除去氯化氢,理由是(用化学方程式表示) _________________________。
2.A是一种碱,B是一种盐。它们的溶液可发生下图所示的变化:

(1)写出A、B、C、D、E的化学式:A________;B________;C________;D__________;E________。
(2)写出反应①、②、③的化学方程式:
反应①____________________________________,
反应②____________________________________,
反应③____________________________________。
四、计算题(本大题包括2个小题。共12分):
1.实验室中浓硫酸的商标如下图所示。请根据有关信息计算:
硫酸 化学纯(CP)
(500mL)
品名 硫酸
化学式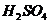 相对分子质量98
相对分子质量98
密度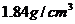 质量分数98%
质量分数98%
(1)该试剂瓶中硫酸溶液的质量是________________g。
(2)欲配制100g溶质质量分数为19.6%的稀硫酸,需这种浓硫酸多少克?
(3)取足量的稀硫酸与6.5g锌充分反应,可制得氢气多少克?
2.在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐。这里的碱是指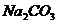 ,盐是指
,盐是指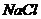 。人们从盐湖中捞得的碱会含有少量的
。人们从盐湖中捞得的碱会含有少量的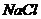 。某研究性学习小组称取含
。某研究性学习小组称取含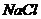 的
的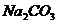 固体13.25g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到
固体13.25g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到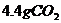 气体。
气体。
试计算:(1)原固体中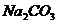 的质量分数
的质量分数
(2)反应中消耗稀盐酸的总质量