2007年枣庄市滕州市中考复习第二次调研考试九年级化学试卷
*可能用到的相对原子质量:H l C 12 N 14 O 16 Na 23 Mg
S 32 Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Zn 65
一、选择题(每小题只有一个选项符合题意.把正确答案序号填入下列表格中。每小题2分.共16分)
1.类推是化学学习中常用的思维方法。以下4个类推结果正确的是
A.醇类物质在空气中完全燃烧生成CO2和H2O,甲醇是醇类的一种,所以甲醇完全燃烧生成CO2和H2O
B.氧化物都含有氧元素,所以含有氧元素的化合物就是氧化物
C.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应
D.燃烧一定伴随发光、发热现象,所以有发光、发热现象的就是燃烧
2.
①及时指挥人群向较高地势转移
②被转移人群应戴上用碱性溶液处理过的口罩
③用高压水枪向空中喷洒含碱性物质的水溶液
④将尚有残留液氯的槽罐移入附近水塘中,并向水塘中加入生石灰
A.① B.①② C.①②③ D.①②③④
3.下列实验操作不必要使用玻璃棒的是
A.溶解 B.过滤 C.蒸发 D.称量
4.下列化学方程式与事实相符的是
A.生石灰放置在空气中质量增加:Ca(OH)2+ CO2 ====CaCO3↓+H2O
B.湿法冶铜的原理: Fe+CuSO4 ====Cu+FeSO4
C.氢氧化铝治疗胃酸过多:Al2O3+6HCl====2AlCl3+3 H2O
D.木炭还原氧化铁:
5.海水淡化可用膜分离技术。如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是
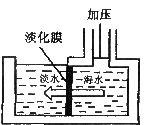
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
6.将CO、N2、O2、HCl 四种气体的混合物依次通过Na2CO3溶液、灼热的铜网、石灰水、灼热的氧化铜,最后剩下的气体是( )
A.N2和CO
B.N
7.CaCO3→Ca(OH) 2→NaoH的各步转化中,没有涉及到的基本反应类型是
A.复分解反应 B.化合反应 C.置换反应 D.分解反应
8.锌粉、铝粉、铁粉、镁粉的混合物
A.
二、填空题(本题共6小题,22分)
9.(5分)在H、O、C、Cl、Ca五种元素中,选择适当元素,组成符合下列要求的物质,将其化学式填入空格中:
可用于人工降雨的氧化物 ;可用于金属表面除锈的酸 ;可改良酸性土壤的碱 ;可作干燥剂的金属氧化物 ;相对分子质量最小的氧化物是 。
10.(4分)有W、X、Y、Z四种物质,它们在一定条件下有如下转化关系:
①W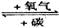 CO2 ②Y
CO2 ②Y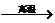 CaO十X
CaO十X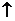 ③Z(溶解)+X→Y↓(白色)+ H2O 请写出各物质问相互转化的化学方程式:
③Z(溶解)+X→Y↓(白色)+ H2O 请写出各物质问相互转化的化学方程式:
① , 。
② 。
③ 。
11.(3分)一定质量的碳在氧气中恰好完全反应生成气体,用“纯净物、混合物”填下列空白:
(1)若生成的气体中碳元素与氧元素的质量比为3:8,则生成物为 。
(2)若生成的气体中碳元素与氧元素的质量比为3:4,则生成物为 。
(3)若生成的气体中碳元素与氧元素的质量比介于3:8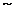 3:4之间,则生成物为 。
3:4之间,则生成物为 。
12.(2分)中考前,枣庄市对初中毕业生进行化学实验操作考核,小翔抽到的题签是:检验溶液的酸碱性。他选择紫色石蕊试液完成了这个实验。一直喜欢科学探究的他在得知成绩合格后,立即向老师询问,知道了样品1是稀NaCl溶液,样品2是稀HCl溶液,样品3是稀Na2CO3溶液。细心的小翔还发现自己的废液缸里的废液显红色;请你帮助小翔分析:
(1)废液里一定含有的物质是 (石蕊试液和水不填)。
(2)废液呈红色的原因可能是 。
13.(4分)锌与盐酸反应可制得氢气,另一产物为氯化锌,试写出反应的化学方程式
。
(1)一变:若用A+B→AB表示化合反应。AB→A+B,表示分解反应,则上述反应可表示为 。
(2) 二变:若用
(3)三变:若用
14.(4分)实验探究:氢氧化钠溶液中哪一种粒子(H2O、Na+、OH-)能使指示剂变色。
实验步骤:
(1)在第一支试管中加入约2 mL蒸馏水,滴人几滴无色酚酞试液,观察现象;
(2)在第二支试管中加入约2 mL NaCl(pH=7)溶液,滴入几滴酚酞试液,观察现象;
(3)在第三支试管中加入约2 mL NaOH溶液,滴入几滴无色酚酞试液,观察现象;
通过上述实验的探究,回答下列问题(下述“现象”是指:无色酚酞试液是否变红):
实验(1)你得出的结论是: ;
实验(2)说明Na+离子 ;
实验(3)看到的现象是 ;你得出的结论是: 。
三、实验题(7分)
15.请根据下图装置,回答问题:
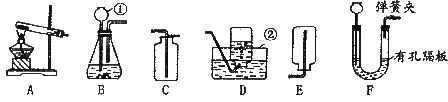
(1)写出标号①②的仪器名称:① ②
(2)实验室用Zn与稀H2SO4制取H2,可选用装置 (填写装置序号)能收集到较纯净的H2。
(3)用高锰酸钾制取O2,装置A还需做的一点改动是 。
(4)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下
四步实验操作可回收二氧化锰。正确操作的先后顺序是 。(填写选项序号)
A.烘干 B.溶解 C.过滤 D.洗涤
(5)把(4)中滤液蒸发结晶可得到氯化钾晶体,在蒸发操作中玻璃棒的作用是
。(6)用装置F制取气体,在反应过程中,用弹簧夹夹住导气管上的橡皮管,过一会儿反应就会停止。其原因是 。
四、计算题(5分)
16.(5分)已知Na2O2是一种淡黄色粉末,易与水反应,生成氢氧化钠和一种能使带火星的木条复燃的气体。现有Na2O和Na2O2的混合物
(1)在上述溶液中加入质量分数为3.65%的盐酸,若充分反应后,溶液呈中性。加入盐酸的质量是多少?
(2)计算原混合物中Na2O和Na2O2的质量。