2005年山东省青岛市模拟试题二
第I卷(选择题)
相对原子质量 H-1 O-16 C-12 Na-23 Fe-56 Mg-24 N-14 S-32 Cl-35.5 Zn-65
一、选择题(本题共16道小题,每题各有一个正确答案,共16分)
1. 呼吸作用及光合作用都离不开空气。下列关于空气的说法正确的是( )
A. 空气是一种化合物
B. 空气是几种单质和几种化合物组成的混合物
C. 新鲜的空气是纯净物
D. 空气是几种元素的混合物
2. 下列有关物质的用途中,利用其物理性质的是 ( )
A.氧气用于炼钢 B.铜用于制导线
C.氮气用作灯泡填充气 D.镁用于制照明弹
3.报载一辆满载浓硫酸的槽罐车在路上因车祸翻倒,浓硫酸大量泄漏,为了不污染旁边的水源,下列采取的措施适宜的是( )
A .用水冲洗泄漏的浓硫酸
B.将熟石灰撒在泄漏出的浓硫酸上
C.将氯化钡撒在泄漏出的浓硫酸上
D.用土将泄漏出的浓硫酸掩埋
4. 下列物质中属于非金属单质的是( )
A. 水 B. 氮气 C. 硫酸 D. 铝
5、下列说法正确的是 ( )
A.厨房洗涤剂具有溶解油污的作用
B.冰投入水中,冰是溶质,水是溶剂
C.NH4NO3溶于水制成的冰袋可用于给高烧病人降温
D.冬季向公路上的积雪撒盐,可使冰雪快速融化
6. 铁是一种应用广泛的金属,下列有关铁的说法中正确的是( )
A 铁丝在氧气中燃烧生成氧化铁
B 铁在干燥的空气中容易生锈
C 铁是地壳里含量最多的金属元素
D 用铁锅炒菜可使事物中增加微量铁元素
7. 下列有关“化学之最”的叙述中,错误的是( )
A. 最简单的有机物是甲烷
B. 相对分子质量最小的气体是氢气
C. 天然存在最硬的物质是金刚石
D. 地壳中含量最多的元素是铝元素
8. 有关下列物质的用途不正确的是( )。
A.氢氧化钠可用于制肥皂和造纸
B.利用盐酸可除去金属表面的锈
C.生石灰可用做食品袋中的干燥剂
D.浓盐酸可以用来干燥氢气
9. 蛋白质是人体必需的重要营养成分之一。下列食物中,富含蛋白质的是( )
A.豆腐 B.馒头 C.西红柿 D.豆油
10. 用一种试剂鉴别稀盐酸、氯化钠溶液和氢氧化钠溶液,应选用的试剂是
A.氯化钡溶液 B.紫色石蕊试液 C.硝酸银溶液 D.无色酚酞试液
11. 下列各组物质可按溶解、过滤、蒸发的操作顺序分离的是
A 氯化钾和碳酸钙 B 硝酸钾和硝酸钠
C 氧化铜和炭粉 D 水和植物油
12. “绿色化学”要求从根本上消灭污染,它包括“原料的绿色化”“化学反应的绿色化”“产物的绿色化”等内容。其中“化学反应的绿色化”要求原料物质中所有的原子完全被利用且全部转入期望的产品中。下列符合“化学反应的绿色化”的是( )。
A.化工厂用氨、二氧化碳和水制碳酸氢铵:NH3+H2O+C02=NH4HC03
B.实验室用石灰石和稀盐酸反应制取二氧化碳:CaCO3+2HCl=CaCl2+C02↑+H20
c.氯化铵与消石灰混合研磨产生氨气:2NH4C1+Ca(OH)2=CaCl2+2NH3↑+2H20
D.氢化钙(CaH2)与水反应可以得到氢气:CaH2+2H20=Ca(OH)2+2H2↑
13. 若有化学反应4M+3N2=2MXNY,则X、Y的数值是( )
A、X=4 Y=6 B、X=2 Y=3 C、X=1 Y=2 D、X=3 Y=2
14. pH=4的盐酸,如要使其pH升高,可向溶液中①加水、②加pH=0的盐酸、③加pH=2的盐酸、④加氨水,其中正确的是( )。
A.①②③④ B.①③④ C.②③④ D.①④
15.
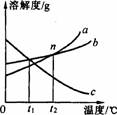
上图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.c一定是熟石灰的溶解度曲线
C.三种物质的饱和溶液分别从t2 降温至t1℃,a、b析出的晶体质量相等
D.n点表示在t2℃时,a、b两种物质的饱和溶液溶质质量分数相同
16.欲除去氮气中的少量氧气、水蒸气、一氧化碳、二氧化碳等杂质,可使混合气体通过下列物质:(1)澄清的石灰水;(2)灼热的氧化铜;(3)灼热的铜;(4)浓硫酸。顺序正确的是( )
A、(1)(2)(3)(4) B、(3)(2)(1)(4)
C、(4)(2)(1)(3) D、(2)(4)(3)(1)
二、选择题(本题共8道小题,每题各有一个或两个正确答案,共16分)
17. 香烟燃烧产生的烟气中含有许多强致癌物和有害物质,其中对人体危害最大的是尼古丁(化学式C10H14N2)、焦油和一氧化碳等。下列说法中错误的是 ( )
A.学校应当成为无烟场所
B.尼古丁由碳、氢和氮三种元素组成
C.C10H14N2中,碳、氢、氮三种元素的质量比为10:14:2
D.CO易与血液里的血红蛋白结合,使血红蛋白携氧能力降低
18. 为了验证Fe、Cu、Ag三种金属的金属活动性顺序,下列各组所提供的试剂无法得出结论的是 ( )
A.Fe、Ag、CuSO4溶液 B.Cu、FeSO4溶液、AgNO3溶液
C.Fe、Cu、稀盐酸、Ag D.Cu、Ag、FeSO4溶液
19.小童将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是
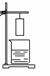
A
B
C
D
滤纸上的指示剂
酚酞试液
酚酞试液
石蕊试液
石蕊试液
烧杯中的溶液
浓氨水
浓盐酸
浓氨水
浓盐酸
20.下列说法正确的是( )
A、100ml溶质质量分数为40%(密度为1.3g /ml )的硫酸溶液中含硫酸的质量为40g
B、30℃时,100g饱和KCl溶液中含 27gKCl,则30C,KCl的溶解度不等于27g
C、30℃时100g水中最多溶解37gKCl,则30CKCl饱和溶液中溶质的质量分数为37%
D、20℃时硝酸钾溶液的质量分数为5%,可理解为100g硝酸钾溶液中含硝酸钾5g
21. 用锌、氧化铜、稀硫酸作原料,采取下列两条途径制取铜:
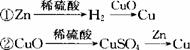
若这两种方法制得的铜的质量相等,则下列叙述符合实际实验结果的是( )
A.一定消耗相同质量的氧化铜
B.一定消耗相同质量的锌
C.消耗的稀硫酸的质量不相同
D.一定生成相同质量的硫酸锌
22.若将50g18%的氢氧化钠溶液与50g18%的盐酸混合,下列叙述正确的是( )
A.混合溶液的PH等于7 B.混合溶液的PH大于7
C.混合溶液的质量为100g D.混合后溶液中的溶质只有一种
23. 有四瓶无色溶液,它们分别是:①稀盐酸 ②稀硫酸 ③NaOH溶液 ④Na2SO4溶液。某实验小组分别对四种溶液进行了一系列实验,结果如下表:
甲
乙
丙
丁
加入无色酚酞溶液
不变色
变红
不变色
不变色
加入BaCl2溶液
白色沉淀
无明显现象
白色沉淀
无明显现象
加入Na2CO3溶液
无明显现象
无明显现象
产生无色气体
产生无色气体
则对应甲、乙、丙、丁顺序的四种物质是( )
A.②①③④ B.④③②① C.③④①② D.①②④③
24. 等质量的锌、铁、镁分别与三份溶质质量分数为20%的稀硫酸恰好完全反应,下列有关说法正确的是( )
A、反应后产生氢气的质量可能相等
B、反应后产生的氢气的质量不相等
C、与金属反应的稀硫酸溶液的质量可能相等
D、与金属反应的稀硫酸溶液质量为:Mg> Fe > Zn
第II卷(非选择题)
三、填空题
25.按要求从烧碱、盐酸、浓硫酸、熟石灰、氢氧化铝等物质中选择适当的物质,将其化学式填在相应的空格里:
(1)少量存在于人的胃液中,能帮助消化的是__ __。
(2)在医疗上,可用来制造中和胃酸过多的药物的是__ __。
(3)可用做某些气体的干燥剂的是_ ___ 。
(4)可用做建筑材料的是___ _。
26.“有其他物质生成“是判断物质发生化学变化的依据。但在实际化学反应中,常常根据反应伴随的现象来确定化学反应是否发生。根据你对化学反应的理解填写下表:
实验内容
主要实验现象
化学方程式
在盛有硝酸银溶液的试管中,插入一根洁净的铜丝
有白色沉淀生成
Fe2O3+6HCl==2FeCl3+3H2O
28.实验证明,含有+3价铁元素的化合物,通常具有氧化性,如在FeCl3溶液中,三氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答下列问题:
⑴该反应的化学方程式可表示为 。
⑵向上述反应后的溶液中加入过量的锌粉充分反应后过滤,则滤纸上一定有的固体是(写化学式) ,滤液中的溶质是 (化学式)。
四、简答题
29.请你简要分析下列实验出现异常现象的原因:
(1)点燃氢气时发生爆炸_______________________________
(2)蒸发氯化钠溶液时液滴飞溅_______________________________
30.某学习小组的同学,欲在不使用酸碱指示剂的条件下,通过添加试剂的方法将含有盐酸的氯化钙溶液变为中性。甲同学提出选用石灰石粉末,乙同学提出选用澄清的石灰水。比较甲、乙两同学所选试剂,你认为 同学的选择不可行;理由是:该试剂虽然能除去原混合液中的 ,但 。
31.已知氯化钠、纯碱在不同温度时的溶解度:
温度/℃ 溶解度/g
0
10
20
30
40
氯化钠
35
35.5
36
36.5
37
纯碱
6
10
18
36.5
50
(1)根据表中所给数据,你能获得哪些信息?
(2)生活在盐碱湖附近的人们“夏天晒盐、冬天捞碱”。你能说出其中的原因吗?
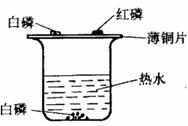
五、实验题
32.判断正误(正确的在体后括号内画“ √ ”,错误的画“ Ⅹ ” )
(1)用漏斗过滤时,将液体沿漏斗壁倒入过滤器。( )
(2)如果酸流到桌子上,应立即加适量的碳酸氢钠来中和。( )
(3)生石灰中混入少量碳酸钙,应加入适量的稀盐酸除去。( )
(4)试管内壁只要没有不溶性固体存在,就算洗干净了。( )
33.小浪用右图所示装置探究可燃物燃烧的条件。他发现热水中的白磷熔化成一
白色小液滴,不久,铜片上的白磷开始燃烧,而红磷及水中的白磷都不燃烧。请回答:
(1)可燃物燃烧需要同时满足的条件是 :
(2)白磷具有的物理性质是 :
(3)实验完毕,小浪将烧杯中的热水慢慢倒出,水快倒完时,小浪发现白磷刚露出峦面就剧烈燃烧起来,请解释该现象
写出白磷燃烧的化学方程式
;
(4)通常保存少量白磷的方法是 。
34.在某氢氧化钙稀溶液中滴入2~3滴酚酞试液,溶液呈现红色。将此溶液在空气中露置一段时间后,发现红色消失了。请你对此现象作出合理的解释,通过实验证明自己的观点。
红色消失的原因
验证方法
实验现象
结论
35.从含有大量硫酸亚铁、少量硫酸铜以及不溶性杂质的工业废水中回收金属铜并获得硫酸亚铁晶体,操作步骤和目的如下表,请填出表中未完成部分。
操作步骤
目 的
(1)将废水过滤 (2)向滤液中加入过量铁粉 (3) (4)在过滤后的固体混合物中加入过量稀硫酸 (5)将反应后的混合物过滤 (6)
(1) (2) (3)将Cu和过量的铁粉与FeSO4溶液分离 (4) (5) (6)得到硫酸亚铁晶体
六、计算题
36.已知尿素的化学式为CO(NH2)2 ,其中:
⑴ 氮、氢元素的质量比= ;
⑵ 氮元素的质量分数为 。
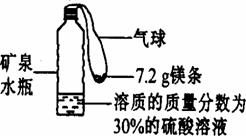
37.某实验小组同学设计了下图装置模拟氢气探空气球(装置中气球固定在矿泉水瓶上)。将气球中的镁条加入到硫酸溶液中,恰好完全反应。
(1)计算反应生成氢气的质量。
(2)计算反应后生成的硫酸镁溶液的质量。