1998年全国初中学生化学素质和实验能力竞赛
(第八届天原杯)复赛试题
可能用到的相对原子量:H-1 C-12 N-14 O-16 P-31 S-32 Cl-35.5 Mg-24 Al-27 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137
一、选择题(本题12小题,每个题3分,共36分;每小题有1个或2个选项符合题意,若有两个答案,只选1个给1分,选对1个另1个选错或多选都不给全。)
1.酸雨对下列物质的腐蚀作用最强的是( )
A铜制塑像 B大理石雕刻 C水泥路面 D铝制窗框
2.下列措施是为了防止环境污染的是( )
A食盐加碘 B禁止使用含铅汽油 C禁止饮用工业酒精 D禁止鸣放鞭炮
3.黄金首饰的纯度常用“K”来表示24K是纯金、标号为18K的首饰中黄金的质量分数是( )
A 25% B 75% C 18% D 36%
4.氯仿(CHCl3)不溶于水,密度比水大,是一种良好的有机溶剂,因保存不当受光照易被氧化而产生剧毒的光气(COCl2),反应如下:2CHCl3+O2 2HCl+2COCl2,则有关氯仿的以下实验操作正确的是( )
2HCl+2COCl2,则有关氯仿的以下实验操作正确的是( )
A用酚酞试液检查氯仿是否变质 B用硝酸银溶液检查氯仿是否变质
C用水检验氯仿是否变质 D需要倾倒氯仿检验时应在通风橱中进行
5.氢氧化钙在80℃时的溶解度为x克,20℃时Ca(OH)2溶解度为y克,取80℃时Ca(OH)2的饱和溶液a克蒸发掉w克水后,再恢复至20℃,滤去折出固体,滤液中Ca(OH)2的质量分数为z%,则x、y、z的关系正确的是( )
A x>y>z B y<z<x C x<y D y>z
6.下列对a、b、c、d四套装置中,在注入酸起反应后,关闭分液漏斗的活塞,对气球的变化情况作出正确分析的是( )
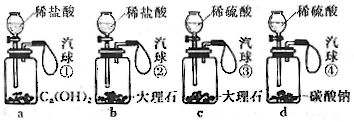
A气球①不胀大,②-④都能迅速胀大 B气球②逐渐胀大,气球④迅速胀大
C气球②逐渐胀大,气球③缓缓膨胀后停止,气球④迅速胀大 D以上都不正确
7.a、b、c、d是1-18号元素,a、b元素的阳离子和c、d元素的阴离子都具有相同的电子层结构,且b元素原子的最外层电子数比a元素原子的最外层电子数少,c的阴离子所带的负电荷比d的阴离子所带的负电荷多,则它们的核电荷数大小关系是( )
A a>b>d>c B c>b>a>d C a>b>c>d D b>a>c>d
8.一包混有杂质的Na2CO3,其杂质可能是Ba(NO3)2、KCl、NaHCO3,今取10.6克样品,溶于水得澄清溶液,另取10.6 克样品,加入足量的盐酸,收集到4.4克CO2,则下列判断正确的是( )
A样品中含有NaHCO3 B样品中含有NaHCO3,无KCl
C样品中含有NaHCO3也有Ba(NO3)2 D样品中混有KCl也有NaHCO3
9.固体物质A与盐酸反应生成物质C,C的溶液中加入火碱,生成物质D,D受热后得到固体A,则A可能是( )
A Fe2O3 B CO2 C CuO D Na2O
10.将一严重锈蚀而部分变成铜绿的铜块研磨成粉末,在空气中充分灼烧成CuO,发现固体质量在灼烧前后保持不变,灼烧前粉末中单质铜的质量分数是( )
A 52.5% B 50.0% C 70.0% D 48.3%
11.在AgNO3、KNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,过滤,洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子是( )
A Cu2+ B 只有Fe3+ C Fe2+ D K+
12.a、b、c、d可能是Na2CO3、AgNO3、BaCl2、HCl四种溶液中各一种,把它们两两混合后产生如下现象。a、b、c、d依次是( )
A Na2CO3、AgNO3、HCl 、BaCl2
B AgNO3、Na2CO3、BaCl2 、HCl
C HCl、AgNO3、BaCl2、Na2CO3
D BaCl2、HCl、Na2CO3、AgNO3
二、填空(13分)
13.海洛因、鸦片、大麻都是严重危害人类健康的毒品,其中大麻主要成分的化学式为C21H30O2,在空气中焚烧大麻主要成分的化学方程式是___________________________。
14.已知含负一价的氢的化合物(如:NaH)与水接触生成相应的碱和氢气,试写出CaH2与Na2CO3水溶液反应的化学方程式______________________________。
15.CO和O2在催化剂和加热条件下,很容易发生下列反应:
又已知标准状况下22.4cm3CO2与足量的饱和澄清石灰水作用可生成CaCO3 100mg。
现针筒内贮有200cm3CO2、CO、O2的混合气体,(已折算成标准状况)。假设其中CO2为xcm3,CO为ycm3,其余为O2(过量)
某校初三化学实验小组利用以下实验仪器,组装成一套实验装置,用来测定混合气体中各气体的体积:
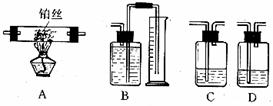
请回答下列问题:
⑴从针筒压出的气体,从左到右流过的装置连接顺序应该是:________(用A、B、C、D表示)。
⑵吸收瓶C和D中所盛的吸收溶液是足量的________溶液,装置B中所盛可以是______。
⑶实验完毕后,在装置B量筒中液体的体积约为_____________cm3(用含x,y的式子表示)。
⑷在⑴装置中,从左数第一个吸收瓶中产生的CaCO3质量约为_________mg;第二个吸收瓶产生的沉淀质量约为________mg。(用含x或y的式子表示)。
⑸如果第一个吸收瓶[在⑴装置中]中得到200 mg CaCO3沉淀,第二个吸收瓶得到150mg沉淀,则原混合气体中含CO2的体积为________cm3,;含O2________cm3。
16.岩石、矿物的结构复杂,其成分可用氧化物的化学式来表示,如硅酸钙CaSiO3可表示为CaO?SiO2。试用氧化物的化学式表示下列矿物的成分:
⑴棉花:CaMg3Si4O12________________;⑵白云母:K2Al6Si6(OH)8O18 _____________。
三、实验题(共18分)
17.某同学欲检验NaOH粉末中是否混有Na2CO3,他设计了三个实验方案如下:
方 案
结 论
你对实验方法和结论的评价
方案1
样品溶于蒸馏水,把pH试纸投入溶液中,若pH大于7
混有Na2CO3
方案2
取少量样品溶于蒸馏水后滴入CuSO4溶液,有蓝色沉淀出现
混有Na2CO3
方案3
取少量样品溶于蒸馏水后滴入足量BaCl2溶液,有白色沉淀
混有Na2CO3
18.钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时,却可与许多常见非金属单质反应,钛是航空、宇航、军工、电力等方面的必需原料,地壳中含钛矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步,金红石、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体,该步发生的反应的化学方程式是: ,该反应的还原剂是_______。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
⑴此反应的化学方程式_____________________________;
⑵如何由上述所得产物中获得纯净金属钛?简述主要实验步骤并写出有关反应的化学方程式________________________________。
19.某学生利用大试管、长颈漏斗、量筒、水槽、胶塞(有孔)、玻璃导管、橡皮导管,还有秒表等器材设计一套发生H2实验装置,并用排水集气法将H2吸收于量筒中,用秒表记录反应时间,观察一定时间内产生H2的体积。
请回答下列问题:
⑴画出发生和吸收H2的装置图(铁架台等不画出):
⑵实验记录如下(注:H2的体积已折算为标准状况):
时间(分钟)
1
2
3
4
5
6
7
8
 (mL)
(mL)
100
160
200
224
224
224
224
224
回答:反应的前2分钟内,每分钟平均产生H2的体积是___________mL,反应的前4分钟内每分钟产生H2的体积是____________mL。
⑶已知65g锌与足量盐酸反应,能产生22.4L H2(标准状况)。上述实验中加入的10g盐酸中反应后只用去一半,则反应的锌为________g,原盐酸中溶质的质量分数为________。
四、(共19分)
20.A、B、C、D、E五种物质都是含二价金属元素X的化合物,它们之间存在下列转化关系,图中H,G,F为另加的试剂。
根据以上关系回答:
⑴ X元素是_______。
⑵写出有关物质的化学式:A__________,B__________,C___________,D__________,
E_________,F__________,G__________, H_________。
⑶写出D→A,E→D,A→E的化学方程式:D→A_____________________________
E→D_____________________________ A→E_____________________________
21.实验设计,自然界矿物中一种重晶石矿的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用,课外活动小组同学,用重晶石矿、焦炭为原料,制取纯净硫酸钡。(设矿物中杂质不与焦炭反应,也不溶于水)部分流程如下:
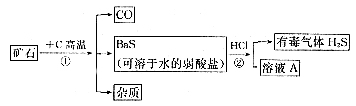
按要求填空:
⑴在步骤①中,哪些元素化合价升高了,哪些元素化合价降低了? 。
⑵写出步骤②中溶液A的溶质的化学式________;
⑶写出利用A溶液制取Ba(OH)2的化学方程式: 。
⑷有同学指出,上述步骤②产生有毒气体H2S,应将方法加以改进,请你提出改进意见,使该实验既不产生H2S,又能获纯净BaSO4。请写有关化学方程式___________________。
五、计算(共14分)
22.锌粉、铝粉、铁粉、镁粉的混合物a克与一定质量的溶质质量分数为25%的稀硫酸恰好完全反应,蒸发水分后得固体C(不含结晶水)b克。求反应过程生成H2多少克
23.煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤烟中含有硫的化合物(如FeS2),燃烧时生成SO2气体造成环境污染。
设某具有30万户人口的中等城市,每户每天烧煤5千克,这种煤中含FeS25%,燃烧时,设有90%的硫转化为二氧化硫,被排放入大气之中。
硫铁矿燃烧时的反应方程式为4FeS2+11O2=2Fe2O3+8SO2,问:
⑴燃烧1吨煤,可产生多少千克的SO2?
⑵该中等城市,如果全部以上述的煤做燃料,每年将有多少吨二氧化硫排放到大气中?