2006年山东省中等学校招生考试 (大纲卷)
第一卷( 选择题 共18分)
一、选择题(本题包括9个小题,每小题2分,每题只有一个选项符合题意)
1.下列过程中没有发生化学变化的是
A.鲜奶制酸奶 B.二氧化碳制干冰 C.粮食制米酒 D.石墨制金刚石
2.黄河是我们的母亲河,化学学习小组的同学经过调查和搜集资料得知,可以通过①化学沉降(用明矾)②杀菌消毒(用漂白粉)③自然沉降 ④过滤等几个步骤对黄河水进行净化。请选择合理的操作顺序
A.①③②④ B.①③④② C.③④①② D.③①④②
3.化学的发展对改善人们的生存环境和促进社会发展有着积极的作用,下列各项利用化学变化与其所要达到的目的不相符的是
A.合成药物 抑制细菌和病毒
B.生产化肥、农药 增加粮食产量
C.开发新材料、新能源 改善生存条件,提高生活质量
D.合成食品添加剂 增进人体健康
4.为了揭开原子内部结构的奥秘, 1911年著名物理学家卢瑟福等人做了一个著名的“卢瑟福实验”:用一束带正电的、质量比电子大很多的高速α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,甚至有极少数的α粒子被反弹了回来。通过这一实验现象不能获得的结论是
A.原子核质量较大 B.原子核体积很小
C.核外电子带有负电荷 D.原子核带有正电荷
5.在通常情况下,通过实验测定一瓶气体中只含有C、H两种元素,则这瓶气体不可能是
A.一种化合物 B.两种单质的混合物
C.一种单质和一种化合物的混合物 D.两种化合物的混合物
6.下列实验操作中,正确的是
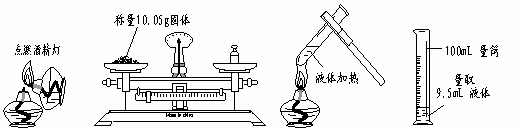
A B C D
7.化学学科的思维方法有多种,其中推理是常用的思维方法。以下推理正确的是
A.氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物
B.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
C.燃烧一般都伴随发光、发热现象,所以有发光、发热现象的就是燃烧
D.有机物完全燃烧时都产生二氧化碳,所以有机物中一定含有碳元素
8.下列操作或现象与分子的性质相对应的是

9.分析以下实验数据或实验操作,你认为正确的是
A.没有说明用量时,用试管取用液体药品的体积一般为1~2mL
B.用pH试纸测得某NaOH溶液的pH为12.7
C.用胶头滴管取液后,要平放或倒置,以防液体流出
D.蒸发皿和烧杯都可以作为液体反应或给液体加热的容器,直接在酒精灯上加热
第二卷(非选择题 共32分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Ca-40 Ba-137
二、填空与简答题( 本题包括6小题 共20分)
10.(4分)生活中有许多物质需要密闭保存,如酒精溶液和碳酸饮料。因为酒精易挥发,挥发出的是 __________(填名称)分子;碳酸饮料中碳酸易分解,分解出的物质是_________。结合以上两个实例,谈谈你对挥发和分解反应的认识_______________________________, 写出酒精燃烧的化学方程式________________________________。
11.(3分)小巍同学通过实验绘制的两种固体物质的溶解度曲线如下图所示:
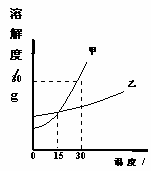
(1)30℃时,甲物质的溶解度是___________;
(2)从右图中还可获得的信息是 ______________________________
(至少答出两条)。
12.(4分)在H、O、C、S 、Fe、Cu六种元素中,选择适当元素,组成符合下列要求的物质,将其化学式填入空格中。
①最简单的有机物______;
②常用的黑色金属____;
③配置波尔多液的盐_______________________。
请利用以上物质写出一个置换反应的化学方程式____________________。

13.(3分)小聪和小明对竹子中气体的成分进行探究。他们把竹子浸泡在水中,在竹子上钻了一个小孔,看到有气泡从小孔中冒出,就用 _______________法收集了两瓶气体。
第一瓶:采用右图所示的方法点燃红磷,有白烟生成。把装置放在水中,打开止水夹,进入集气瓶的水约占集气瓶体积的1/10。
第二瓶:倒入少量澄清的石灰水,振荡,石灰水变浑浊。
由此推断:竹子中含有_______________气体 。
通过实验,他们将竹子中两种气体的含量与空气进行了比较,得出的结论是_______________________________。
14.(3分)在加热氯酸钾和二氧化锰制取氧气的过程中,鉴于制得的氧气有氯气的气味,认为反应过程如下
①2KClO3+2MnO2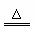 2A+Cl2↑+B↑ ②2A
2A+Cl2↑+B↑ ②2A 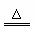 K2MnO4+MnO2+B↑
K2MnO4+MnO2+B↑
③Cl2+K2MnO4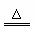 2KCl+MnO2+B↑
2KCl+MnO2+B↑
写出A、B的化学式:A _______B __________。通过以上实例,谈谈你对二氧化锰作催化剂的认识 _____________________________________________________________。
15.(3分)右图是某种治疗胃酸过多药片标签的部分说明,你认为此药片特别注明是咀嚼片的目的是______________________________________,写出反应的化学方程式__________________________________,该反应属于____________________反应。
三、实验题( 本题包括 1个小题 共6分)
16.(6分)“禽流感”是一种H5N1病毒引起的传染病,从禽类发病到人类染病引起全世界的关注。预防这类病毒的方法是消毒,常见的氧化剂、甲醛、碱类物质等都有较好的杀死病毒的作用。其中NaOH溶液因消毒效果好且廉价易得被广泛使用,从而使工业烧碱用量增加。但工业烧碱中含有杂质碳酸钠,为了测定氢氧化钠的质量分数,某工厂甲、乙两实验员分别设计了如下的实验方案:
Ⅰ 甲的实验方案是:准确称量一定质量的烧碱样品于烧杯中加蒸馏水溶解,再加入过量氯化钡溶液至沉淀完全,过滤、洗涤、烘干、称量。
(1)甲实验员洗涤沉淀的具体操作是:向沉淀中加入蒸馏水,然后过滤,重复2~3次 。确认沉淀已洗涤干净的依据是_____________________________。
(2)氯化钡溶液和氯化钙溶液都可以与碳酸钠溶液反应生成沉淀,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是 ________________________.
Ⅱ 乙的方案如下图所示:
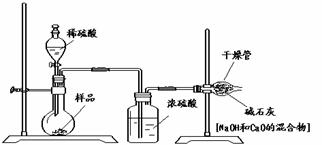
(1)根据乙的实验装置图分析,请你说出浓硫酸的作用是______________________,碱石灰的作用是___________________________。按照乙的方案进行测定,将会导致不可避免的误差,例如:装置内空气中的CO2没有排出;反应产生的CO2未被完全吸收。该设计中还有一项也会导致不可避免的误差,你认为应该是下列选项中的(填序号)______________。
①装置的气密性不好;②加入的稀硫酸量不足;③干燥管与空气直接相通会吸收空气中的水蒸气和CO2。
(2)经测定知,该工业烧碱中氢氧化钠的质量分数为80%,某养殖户需配制2000g 2%的氢氧化钠溶液对禽舍进行杀菌消毒,需这种工业烧碱_______________g。
四、计算题( 本题包括 1个小题 共6分)
17.(6分)汽车工业的迅速发展,给人们的生活带来了很大的方便。因此,汽车的安全性和汽车尾气的排放成为人们关注的问题,根据以下内容回答:
(1)研究证明,汽车尾气系统中,可以安装催化转化器,将尾气中的CO、NO在催化剂的作用下,转化成CO2和N2,以减少尾气对大气的污染,请写出CO和NO在催化剂
的作用下生成CO2和N2的化学方程式_____________________________________,试计算NO中各元素的质量比______________;NO中氮元素的质量分数为_________________。
(2)为增加驾乘人员的安全,驾驶室中设计了安全气囊。当安全气囊受到强烈震动时,气囊中的叠氮化钠(NaN3)会发生分解,迅速产生氮气和固体金属钠,此时,气囊的体积迅速膨胀,以达到保护驾乘人员安全的目的。试计算,在通常状况下,要产生60L氮气,需要分解多少克叠氮化钠?(已知:在通常状况下,氮气的密度约为1.25g/L)