1997年全国初中学生化学素质和实验能力竞赛复赛试题
可能用到的相对原子质量:C-12,H-1,Na-23,O-16,Ca-40,Cl-35.5
一、选择题(每题有1个或2个选项符合题意,每小题2分,共40分)
1.下列叙述正确的是( )
A某物质中含有一种元素,则该物质一定是纯净物 B金刚石和石墨之间的转变一定是化学变化
C不同物质其相对分子质量一定不同 D不同的原子可相互组合成复杂的原子
2.初三课本有一幅彩图,其内容是一只漂亮的金丝雀和水中的金鱼生活“在一起”,制作这个鸟笼的高分子薄膜必须具备的性质是( )
A绝热 B透气 C导电 D隔水
3.我国城市环境中,空气污染物主要是( )
A CO2、Cl2、N2 B SO2、NO2、CO C NH3、CO2、NO D HCl、SO2、N2
4.按照核外电子排布规律:各电子层最多容纳电子数为2n2(n为电子层数);最外层电子数不超过8个;次外层电子数不超过18个,预测核电荷数为118的元素的原子核外电子层排布是( )
A 2,8,18,32,32,18,8 B 2,8,18,32,50,8
C 2,8,18,32,18,8 D 2,8,18,32,50,18,8
5.科学实验证明:空气中微量臭氧(O3)可抵抗阳光中紫外线对人体损害,作空调和冰箱的致冷剂“氟里昂”是一种氯氟烃(以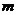 代替其化学式),它可破坏臭氧层,其反应过程可表示为
代替其化学式),它可破坏臭氧层,其反应过程可表示为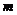 +O3→
+O3→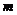 O+O2,
O+O2,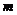 O+O→
O+O→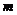 +O2,根据所学知识可知氯氟烃在反应中的作用是( )
+O2,根据所学知识可知氯氟烃在反应中的作用是( )
A氧化剂 B还原剂 C催化剂 D稳定剂
6.下列各组中的物质,只用水就能鉴别的是( )
A固体:氯化钾、硫酸钠、硫酸钡 B气体:氢气、氧气、二氧化碳
C固体:碳酸钙、氯化钠、氢氧化钠 D液体:汽油、水、浓硫酸
7.如果一个碳12原子的相对原子质量为24,则不会改变的是( )
A氧原子的相对质量 B一个碳12原子的质量
C硫酸的式量 D10克二氧化碳所含的分子个数
8.下列广告语中,你认为符合科学道理的是( )
A“超纯水”、“超纯蒸馏水”绝对卫生,对人体有益,
B本饮料由纯天然物质配制而成,绝对不含化学物质,对人体无害
C含氟牙膏可以预防龋齿
D含碘食盐可以防治甲状腺肿大
9.用锌、氧化铜、稀硫酸作原料制取铜,有下列两种途径:
⑴Zn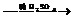 H2
H2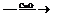 Cu ⑵CuO
Cu ⑵CuO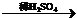 CuSO4
CuSO4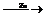 Cu
Cu
若用这两种方法制得的铜的质量相等时,下列叙述符合实际实验结果的是( )
A消耗相同质量的氧化铜 B消耗相同质量的锌
C消耗相同质量的硫酸 D生成硫酸锌的质量可能不同
10.某同学欲配制溶质质量分数为8%的食盐水80克,在用托盘天平称量食盐时,他把食盐和砝码的位置放颠倒了(1克以下用游码),那么实际上他所配制的食盐水的溶质质量分数为( )
A 8.5% B 7% C 14% D 8%
11.核电荷数为1~18的X、Y两元素,X元素原子的最外层电子数与次外层电子数差的绝对值等于电子层数;Y元素比X元素的原子多2个最外层电子,则X与Y不可能形成的化合物是( )
A XY B XY2 C XY5 D X2Y
12.下列括号中的物质是除去杂质所用药品,其中错误的是( )
A氧化钙中有杂质碳酸钙(盐酸) B二氧化碳中有少量一氧化碳(氧气)
C氢气中有氯化氢(氢氧化钠溶液) D硫酸亚铁溶液中有硫酸铜(铁粉)
13.几种物质溶于水,能电离出K+、Mg2+、SO42-、NO3-四种离子,已知其中Mg2+、K+、NO3-离予个数比为4:5:3,则SO42-与NO3-的离子个数比为( )
A 2:1 B 10:3 C 5:3 D 3:5
14.常温下乙烷(C2H6)气体和酒精蒸气的混合物中,氧元素的质量分数为x%,则其混合物中碳元素的质量分数是( )
A 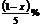 B
B 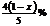 C
C 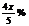 D
D 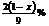
15.某生用含有杂质碳酸钠的烧碱样品与硫酸发生中和反应,那么,与等质量等溶质质量分数的硫酸溶液恰好中和时,所用烧碱样品质量比用纯氢氧化钠的质量( )
A偏高 B偏低 C不变 D无法比较
16.某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
A Na2CO3 NaCl NaOH B NaOH NaCl Na2CO3
C NaCl NaOH Na2CO3 D NaCl Na2CO3 NaOH
17.金属M的样品中含有不跟盐酸反应的杂质,取样品20克投入适量的盐酸恰好完全反应,生成MCl3和2克H2,测知MCl3中含Cl的质量分数为79.8%,则样品中M的质量分数是( )
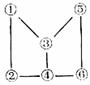
A 90% B 10% C 45% D 54%
18.右图里有6个编号,每个编号代表下列物质中的一种物质,凡用直线连接的相邻两种物质均能发生化学反应,供填写的物质有:a.碳酸钠溶液;b.硫酸镁溶液;c.氯化钡溶液;d.稀硫酸;e.铁;f.硝酸铜溶液,则图中③表示的物质的编号是( )
A e B f C a D d
19.t℃时,向x克KNO3不饱和溶液中,加入a克KNO3或蒸发掉b克水恢复到t℃,溶液达到饱和,据此下列推论错误的是( )
A在t℃时,KNO3的溶解度为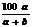 克
克
B若原溶液中溶质质量分数为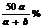 ,则x=2b
,则x=2b
C若原不饱和溶液蒸发掉2b克水,恢复到原温度,能析出2a克KNO3
D在t℃时所配得的KNO3溶液中溶质质量分数≤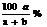 。
。
20.m克金属A(A的原子相对质量为m)与足量稀硫酸反应产生x克氢气,n克金属B(B的原子相对质量为n)与足量稀盐酸反应产生y克氢气,且x=y,若要确定反应中A、B两种金属的化合价,至少需要知道的数据是( )
A x与y的比值 B x或y的确切值 C m与n的比值 D酸的溶质质量分数
二、填空题(共30分)
21.⑴制作松花蛋所需配料有纯碱、氯化钠、生石灰、草木灰(内含碳酸钾)、开水,此外还需要米糠、稻壳等,根据所学知识推断用配料制做时发生的化学反应有(用化学方程式表示)
⑵硫和氧的化学性质相似,在某些化合物中,硫原子可以代替氧原子,请完成下列化学反应方程式:①CS2和Na2S水溶液混合振荡 。
②P2S5溶于Na2S溶液中 。
22.⑴某有机物中,有关元素的质量分数如下:含碳71.58%,含氢6.67%,含氮4.91%,其余为氧,若该有机物分子中只含1个氮原子,则它的式量为 ,化学式是
⑵肥皂的主要成分为硬脂酸钠(C17H35COONa),它是一种有机酸的钠盐,在肥皂水中滴入盐酸会出现白色沉淀,这沉淀物是 (写名称);若在肥皂水中加入硬水(含Ca2+、Mg2+)也会出现白色沉淀,此沉淀主要是 (写名称)。
23.⑴在分开盛放的A、B两溶液中,共含有Na+、Cu2+、Ba2+、Mg2+、NO3-、OH-、SO42-七种离子,两溶液里所含离子各不相同,已知A溶液里含3种阳离子和2种阴离子,其余在B溶液里,则B溶液里所含离子应该是 。
⑵葡萄糖和蔗糖都属于糖类,大多数糖的组成可用Cm(H2O)n表示,式中的“H2O”只说明糖分子中H、O的原子个数比相当于水的组成;糖类通常叫碳水化合物。(当m=n=6时为葡萄糖,当m=12,n=11时为蔗糖)。实验室证实蔗糖是碳水化合物的实验原理是(填文字)
。
24.⑴在CO还原CuO的反应中,Cu元素由+2价变为零价,C元素由+2价变为+4价,在高中化学课本里把元素化合价发生变化的反应叫做氧化还原反应,上述反应中CuO为氧化剂,CO为还原剂,现有下列事实:衣物上沾了KMnO4溶液的污迹不易洗去,若用维生素C制成的溶液擦洗,就能很快洗掉污迹,测知洗涤液中有Mn2+,可以推知擦洗的过程发生了 反应,反应中维生素C起了 作用。
⑵写出实验室以水为基本原料(如需其他试剂,根据价廉易得的原则自己选定)制取H2的两个化学方程式(用两种反应类型) 。
25.⑴将30℃时含有某种溶质的溶液136克,分成两等份,其中一份加入该溶质10克,结果只溶解2克就不再溶解了;将另一份冷却到0℃时,析出溶质5.5克,此时溶液的溶质质量分数为20%,则该物质在30℃时的溶解度为 。
⑵四瓶贴有A、B、C、D标签的溶液,只知道它们是碳酸钾、硝酸钡、硫酸钾、硫酸氢钾的溶液,在不用其他试剂的情况下,对这些溶液进行实验,记录如下:
(提示:KHSO4=K++H++SO42-)
①A+D→溶液+气体
②B+C→溶液+沉淀
③B+D→溶液+ 沉淀
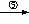 +
溶液+气体
+
溶液+气体
④A+B→溶液+ 溶液
则A、B、C、D的化学式分别为:A 、B 、C 、D
三、实验题(共20分)
26.为了验证烧碱样品中是否含有氯化钠,正确的操作顺序是:
⑴ ;
⑵ ;
⑶ 。
27.向混有少量硝酸铜的硝酸银溶液中加入铁粉,当反应完成后过滤,得到滤液和金属。⑴若向滤液中加入盐酸即生成氯化银沉淀,则滤出的金属是 ,⑵若将滤出金属放入盐酸溶液有气泡产生,则滤液中一定存在的阳离子是 ,不可能存在的离子是 。
28.某学生为了将氯化钠和氯化钙两种固体混合物分离,设计了下列实验方案:
试回答下列问题:
⑴B物质是 (填化学式)。
⑵若用上述实验方法分离得到的NaCl含有杂质,除去杂质的方法是 。
⑶若要测定该混合物中氯化钠的质量分数,除称量B物质外,还需称量另一种物质的质量才能计算确定,这种物质是 。
29.为了确定三种可燃性气体:CH4、H2和CO(简称试验气),分别将它们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶,回答下列问题:
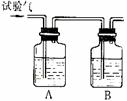
⑴装置A中的液体是 。装置B中的液体是
⑵若装置A的质量增加,B的质量不变,则试验气是 ,
燃烧的化学方程式为 。
⑶若装置A的质量不变,B的质量增加,则试验气是 ,
B瓶中的化学方程式是 。
⑷若装置A、B的质量都增加,则试验气是 ;若B的质量增加m克,则A的质量增加 克。
四、计算题(10分)
30.今有氢氧化钠、碳酸氢钠和与其他物质都不反应受热也不分解的杂质组成的固体混合物17.110克,放入密闭容器中加热至250℃,经充分反应后,将容器中的气体通入过量的澄清石灰水中得到白色沉淀2.500克;当容器中的残留固体冷却到室温后,全部溶于水制成50.00毫升溶液,从中取出10.00毫升,恰好可与含HCl 1.825克的盐酸溶液25.00毫升中和至中性,求原混合物中含杂质的质量分数。