太 原 五 中
2006―2007学年度第二学期月考试题(5月)
高三理科综合
全卷共300分,考试时间为150分钟。
可能用到的相对原子质量:H一1
Li一
S一32 Cl一35.5 K一39 P一31 Cu一64
第Ⅰ卷(选择题,共126分)
一、单项选择题(本题包括13小题。每小题只有一个选项符合题意。每小题6分)
1.右图是人体细胞中两种重要有机物B、E的元素组成及相关关系图。关于此图的叙述中错误的是
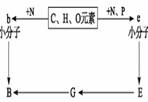 A.E→G和G→B的过程中碱基配对类型完全相同
A.E→G和G→B的过程中碱基配对类型完全相同
B.在噬菌体侵染细菌的实验中,常用35S标记B,用
32P标记E
C.E中e的排列顺序决定了B中b的排列顺序
D.E在氯化钠溶液中的溶解度随着氯化钠浓度的变化
而变化
2.8岁的王小明因一次意外,使得他的下丘脑受到损伤,这损伤可能会导致他的①睾丸的生长发育受到影响 ②甲状腺激素分泌量发生变化 ③体温调节发生障碍 ④血糖含量发生变化 ⑤细胞外液渗透压发生变化 ⑥免疫力下降
A.①②④⑤⑥ B.②③⑤⑥ C.②③④⑤ D.①②③④⑤
3.下列是几个放射性同位素示踪实验,对其结果的叙述不正确的是
A.给玉米提供14CO2,则
B.利用15NH3配制的培养基培养硝化细菌,可在菌体的多糖中测出15N
C.给水稻提供14CO2,则其根细胞在缺氧状态有可能出现
D.小白鼠吸入18O2,则其尿液中可以监测到H218O
4、细胞免疫过程中,细胞中有关变化与发生阶段相符的是
A
B
C
D
DNA大量复制
反应阶段
感应阶段
反应阶段
――
高尔基体活动旺盛
――
效应阶段
效应阶段
――
细胞间信息传递活跃
感应阶段
反应阶段
感应阶段
感应阶段
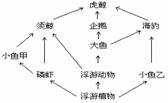 5、根据右边的南极食物网图,你认为正确的是:
5、根据右边的南极食物网图,你认为正确的是:
A.在此食物网中有5条食物链
B.属于三级消费者的动物有两种
C.各种动物分布于不同的水层,属于群落的垂
直结构
D.按最短的食物链算,虎鲸增加
浮游植物
6. 设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A. 常温常压下,O2和O3的混合物
B.
C. 1molC10H22分子中共价键总数为31 NA
D. 标准状况下,
7. 下列各选项所叙述的两个量(同温同压),前者一定大于后者的是
A. 等物质的量的Na2CO3和NaHCO3分别跟足量的盐酸反应放出的气体体积
B. 用量筒量取液体时,仰视的读数和俯视的读数
C. NaHCO3和Na2CO3的溶解度
D. 0.01mol/LCH3COOH溶液和0.1mol/LCH3COOH溶液的pH
8. 在4mol/L H2SO4的溶液和2mol/L HNO3的混合溶液10mL中,加入
A. 89.6mL B. 112 mL C. 168 mL D. 224 mL
9. 运用周期律分析下列推断,其中错误的是
A. 已知Ra是第七周期ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B. 已知As是第四周期VA族的元素,故AsH3的稳定性比NH3的稳定性强
C. 已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应剧烈
D. 已知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小
10. 下列离子方程式正确的是
A. FeSO4溶液中加入用硫酸酸化的H2O2溶液: Fe2+ + H2O2+ 2H+= Fe3+ + 2 H2O
B. 大理石与盐酸反应:CaCO3+ 2H+ = Ca2+ + CO2↑+ H2O
C. NH4HCO3溶液中加入过量NaOH溶液:HCO3-
+ 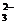 + H2O
+ H2O
D. 向Ca(HCO3)2溶液中加入少量的NaOH:Ca2++2HCO3-
+2OH- =CaCO3↓+CO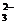 +2H2O
+2H2O
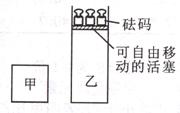 11. 一定温度下,有可逆反应
11. 一定温度下,有可逆反应 C(g)+3D(g);△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如下图)。关于两容器中反应的说法不正确的是
C(g)+3D(g);△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如下图)。关于两容器中反应的说法不正确的是
A. 如果将乙容器的体积压缩为V,当两容器中的反应均达到平衡时,平衡混合物中各组分的体积百分组成不同,混合气体的各组分的浓度也不同
B. 两容器中的反应均达到平衡时,平衡混合物中各组分的体积百分组成相同,混合气体的平均相对分子质量也相同
C. 向乙容器中通入一定量Ar气平衡将不发生移动
D. 在甲容器中再充入2molA和2molB,平衡后甲容器中物质C的浓度是乙容器中物质C的浓度的2倍
12. 下列叙述不正确的是
A. 在小苏打的水溶液中:c(Na+) = c(HCO )+ c(CO
)+ c(CO )+ c(H2CO3)
)+ c(H2CO3)
B. 10mL0.02 mol/LHCl溶液与10mL 0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C. 10mL 0.1 mol / L氨水与10mL 0.1 mol / L盐酸混合:
c(Cl-)>c(NH4+) >c(OH-)>c (H+)
D. 10mL 0.1 mol / L NH4Cl与5mL 0.2 mol / L NaOH溶液混合:
c(Na+) =c(Cl-)>c(OH-) >c(H+)
13. 用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为
14.一定质量的气体做等容变化,气体的温度升高时,下列说法中正确的是
A.该气体分子无规则运动的速率一定增大
B.该气体一定从外界吸收热量而使其内能增大
C.该气体分子的密度变大了
D.单位时间内分子对器壁单位面积的碰撞次数增多
二、选择题(本题包括8小题。每小题给出的四个选项中。有的只有一个选项正确。有的有多个选项正确,全部选对的得6分,选对但选不全的得3分,有选错的得O分。)
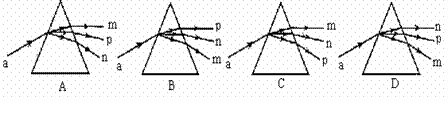
15.已知一束可见光a是由m、n、p三种单色光组成的。检测发现三种单色光中,n、p两种色光的波长都小于m色光;n色光能使某金属发生光电效应,而p色光不能使该金属发生光电效应。那么,光束a通过三棱镜的情况合理的是下列图中的
16. 在发射地球同步卫星的过程中,卫星首先进入椭圆轨道Ⅰ,然后在Q点通过改变卫星速度,让卫星进入地球同步轨道Ⅱ。则以上说法中正确的是
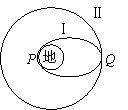 A.该卫星的发射速度必定大于
A.该卫星的发射速度必定大于
B.在轨道Ⅰ上,卫星在P点的速度大于在Q点的速度
C.卫星在Q点通过加速实现由轨道Ⅰ进入轨道Ⅱ
D.该卫星在同步轨道Ⅱ上的机械能大于其在轨道Ⅰ上的机械能
17.下列的四种说法中,正确的是
A.从伦琴射线管对阴极发出X射线时,对阴极中的原子和原子核的结构并没有改变,只是原子从能量较高的定态跃迁到了能量较低的定态
B.放射性元素有γ射线放出时,元素的原子核的组成一定发生变化
 C.由两种元素的原子核结合成一种新元素的原子核时,可能放出能量,
也可能吸收能量
C.由两种元素的原子核结合成一种新元素的原子核时,可能放出能量,
也可能吸收能量
D.在核反应过程的前后原子核的质量数守恒,质量也守恒
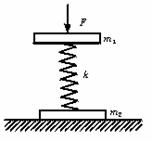
18.两块质量分别为m1、m2的木板,被一根劲度系数为k的
轻质弹簧连在一起,并在m1板上加压力F。为了使得撤
去F后,m1跳起时恰好能带起m2板,则所加压力F的最小
值为
A. m
C.(m1+m2)g D. 2(m1+m2)g
19.下图所示,波源S从平衡位置y=0开始振动,运动方向竖直向上(y轴的正方向),振动周期T=0.01s,产生的简谐波向左.右两个方向传播,波速均为u=
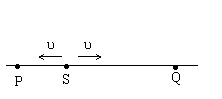 A.甲为Q点振动图象.
A.甲为Q点振动图象.
B.乙为Q点振动图象
C.丙为P点振动图象
D.丁为P点振动图象

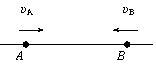
20. 如图所示的直线是真空中某电场的一条电场线,A、B是这条直线上的两点,一电子以速度υA经过A点向B点运动,经过一段时间后,电子以速度υB经过B点,且υB与υA方向相反,则
A.A点的场强一定大于B点的场强
B.A点的电势一定高于B点的电势
C.电子在A点的速度一定小于在B点的速度
D.电子在A点的电势能一定小于在B点的电势能
 21. 如图所示的竖直线段是匀强电场的等势面,质子、
21. 如图所示的竖直线段是匀强电场的等势面,质子、
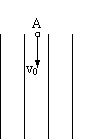 氘核和α粒子以相同的初速度v0 ,与沿等势面平行的 方向由A点进入该电场中,当它们在从上端进入电场到下端离开电场的过程中,它们的动量改变量△P和动能改变量△E之比为
氘核和α粒子以相同的初速度v0 ,与沿等势面平行的 方向由A点进入该电场中,当它们在从上端进入电场到下端离开电场的过程中,它们的动量改变量△P和动能改变量△E之比为
A.△PH:△P氘: △Pα =2:1:1
B.△PH :△P氘:△Pα=1:1:2
C.△EH :△E氘:△Eα=2:2:1
D.△EH:△E氘:△Eα=2:1:2
第Ⅱ卷(非选择题,共174分)
22.( 19分 ) (1)右图是按统计规律得出的氧气分子的速率分布图。
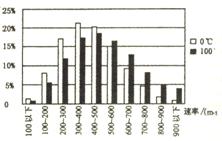 白柱的高度表示在
白柱的高度表示在
;其二是:在不同温度下,不同速率的分子数所占百分比都呈现出 的相同规律。
(2) 一个阻值约为30kΩ的电阻,欲用伏安法较准确地测出它的阻值,备选用的器材有:
A 电源 (E = 16V, r = 2 Ω)
B 电源( E = 3V ,r = 0.5Ω )
C 电压表(量程0~15V ,内阻50kΩ )
D 电压表(量程0~3V, 内程10kΩ )
E 电流表(量程0~500µA,内阻500Ω)
F 电流表( 量程0~1mA ,内阻250Ω )
G 滑动变阻器(阻值0~200Ω)
H 开关一个 ,导线若干
①从上面的器材中选出合适的器材 (用字母表示)
 ②在右边的方框内画出实验电路图.
②在右边的方框内画出实验电路图.
③若实验中用的电源是干电池,
正确连接好电路后电路仍不能正常
工作,需要判断干电池是否已经报废,
可取出一节干电池用多用电表测量它
的电动势,下列步骤中正确的是:( )
1 把多用电表的选择开关置于交流500V或置于OFF档
2 把多用电表的红表笔和干电池的正极接触,黑表笔与负极接触
3 把多用电表的红表笔和干电池的负极接触,黑表笔与正极接触,
4 在表盘上读出电压值,
5 把多用电表的选择开关置于直流25V
6 把多用电表的选择开关置于直流5V,
A 5341 B 2514 C 6341 D 62 4 1
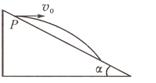 23.( 16分 )如图所示,宇航员站在某质量分布均匀的星球表面一斜坡上P点沿水平方向以初速度v0抛出一个小球,测得小球经时间t落到斜坡上另一点Q , 斜面的倾角为α
, 已知该星球半径为R,万有引力常量为G,
23.( 16分 )如图所示,宇航员站在某质量分布均匀的星球表面一斜坡上P点沿水平方向以初速度v0抛出一个小球,测得小球经时间t落到斜坡上另一点Q , 斜面的倾角为α
, 已知该星球半径为R,万有引力常量为G,
求: (1)该星球表面的重力加速度g;
(2)该星球的密度ρ;
(3)该星球的第一宇宙速度v;
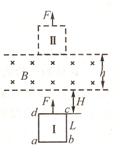 24. ( 18分 )如图所示,在高度差h=
24. ( 18分 )如图所示,在高度差h=
围内,有磁感强度B=0.50 T、方向水平向里的匀强磁场,正
方形线框abcd的质量m=
R=0.50Ω,线框平面与竖直平面平行,静止在位置“I”时,
cd边跟磁场下边缘有一段距离.现用一竖直向上的恒力F=4.0N
向上提线框,该框由位置“I”无初速度地开始向上运动,穿过
磁场区,最后到达位置“Ⅱ”(ab边恰好出磁场),线框平面在
运动中保持在竖直平面内,且cd边保持水平.设cd边刚进入磁
场时,线框恰好开始做匀速运动.(g取
求:(1)线框进入磁场前距磁场下边界的距离H;
(2)线框由位置“I”到位置“Ⅱ”的过程中,恒力F
做的功是多少?线框内产生的热量又是多少?
25.( 19分 )在绝缘水平面上,放一质量为m=2.0 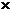 10
10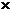 10
10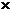 10
10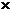 105N/C,滑块A由静止释放后向左滑动并与滑块B发生碰撞,设碰撞时间极短,碰撞后结合在一起共同运动的速度为v=
105N/C,滑块A由静止释放后向左滑动并与滑块B发生碰撞,设碰撞时间极短,碰撞后结合在一起共同运动的速度为v= 10-3J,两滑块始终没有分开,两滑块体积大小不计,与水平面间的动摩擦
10-3J,两滑块始终没有分开,两滑块体积大小不计,与水平面间的动摩擦
 因数为μ=0.50,g取
因数为μ=0.50,g取
求: (1)两滑块在碰撞前的瞬间滑块A的速度;
(2)滑块A起始运动位置与滑块B的距离L`;
(3)两滑块被弹簧弹开后距竖直墙的最大距离sm.
26.(18分) A、B、C、D、E、F均为短周期元素,原子序数依次增大。A元素原子核内无中子。B元素原子核外最外层电子数是次外层电子数的2倍。C元素是地壳里含量最多的元素。D是短周期元素中金属性最强的元素。E与D元素的质子数之和为27,最外层电子数之差为5。F元素的最高价氧化物的水化物为最强酸。
(1)推断B元素在元素周期表中的位置:第_________周期_________族。
(2)画出F元素的原子结构示意图:_____________。
(3)C、D元素可形成淡黄色的粉末,其电子式为:_____________。
(4)写出A与C两种元素形成10电子的粒子:__________、___________、___________。
(5)D、E两元素形成的正盐的水溶液中,阴离子的浓度从大到小顺序为:
________________________________________。
(6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:___________________________________________________。
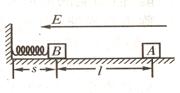
27.(12分)已知A―K是中学化学中常见物质。有如下转化关系(部分生成物已略去)。已知A分解得到B、C、D的物质的量之比是1:1:1。
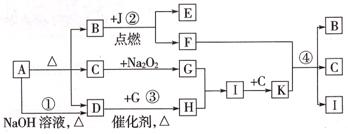
(1)反应④的化学方程式为________________________________。
(2)简述检验D的方法_________________________________。
(3)在工业上生产J单质的化学方程式为________________________________。
|
 (4)若在C
G中参加反应的Na2O2的质量为
(4)若在C
G中参加反应的Na2O2的质量为

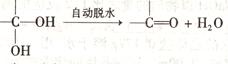
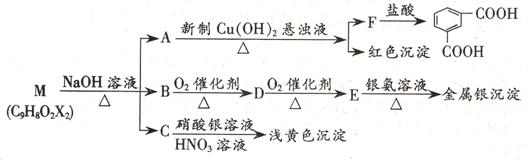
 ①B D:___________________________________________。
①B D:___________________________________________。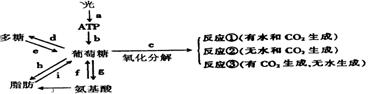
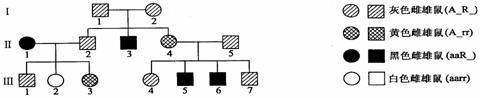
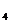 的基因型是____________,Ⅲ4的基因型为AaRr的概率为_____________。
的基因型是____________,Ⅲ4的基因型为AaRr的概率为_____________。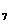 的基因型是____________,若欲进一步确定其基因型,最好让Ⅲ
的基因型是____________,若欲进一步确定其基因型,最好让Ⅲ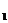 代个体。
代个体。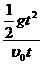 , 则g =
, 则g =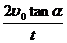 (4分)
(4分)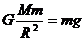 M=
M=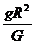 (6分)
(6分) 
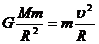
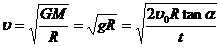 (6分)
(6分)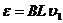 (1分)
(1分)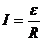 (1分)
,
(1分)
,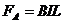 (1分)
(1分) 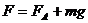 (1分)
(1分)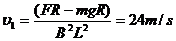 (2分)由
(2分)由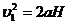 , H=
, H=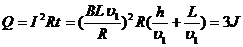
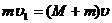
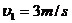 (4分)
(4分)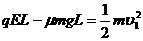 , 解得L =
, 解得L =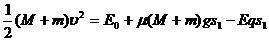
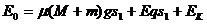
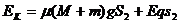 (5分),
(5分),
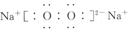
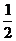 O2(g)= H2O(l);△H=-286kJ/mol或
O2(g)= H2O(l);△H=-286kJ/mol或
 28.每空2分
28.每空2分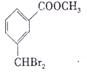
 (4) ① 2CH3OH+O2
2HCHO+2H2O(催化剂写成Cu或Ag也可)
(4) ① 2CH3OH+O2
2HCHO+2H2O(催化剂写成Cu或Ag也可) ③CH3OH +HCOOH
HCOOCH3+ H2O
③CH3OH +HCOOH
HCOOCH3+ H2O