衡水中学2008-2009学年度第一学期期末考试
高二年级化学试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)。满分110分。考试时间110分钟。
可能用到的相对原子质量: H1,C 12,O 16,Na 23,Mg 24,Al 27,Cu 64
第Ⅰ卷(选择题 共50分)
一、选择题(每题只有一个正确答案,每题2分 共50分)
1.医学上在对抗癌物质的研究中发现 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用。对此下列叙述正确的是( )
没有抗癌作用。对此下列叙述正确的是( )
A.两者互为同分异构体,都是以Pt原子为中心的四面体结构
B.两者互为同分异构体,都是以Pt原子为中心的平面结构
C.两者为同一物质,都是以Pt原子为中心的四面体结构
D.两者为同一物质,都是以Pt原子为中心的平面结构
2.能说明镁比铝还原性强的事实是( )
A. Mg的价电子比铝少
B.镁带在空气中和CO2中能燃烧,而铝不能
C. Mg遇浓硫酸不钝化,而铝钝化
D.铝的硬度、延展性、熔点均比镁大、好、高
3.下列说法正确的是(NA为阿伏加德罗常数)( )
A.在1mol甲基(―CH3)中,电子总数9NA
B.在1mol的Na2O2中,有2NA个阴离子
C.标准状况下,
D.Mg、A1为电极,NaOH溶液为电解质溶液所构成的原电池中,导线上流过NA个电子,则正极放出H2的体积为
4.将2mL某气态饱和烃和13mL氧气装入一密闭容器中点燃,测知新得到的只是燃烧产物及过量的氧气,则该烃分子组成中碳、氢元素的质量比不可能是( )
A. 3┱1
B. 4┱
5.下列各组离子,能在指定溶液中大量共存的是( )
①无色溶液中:K+、Cl―、Na+、HCO3-、OH-
②使pH试纸变深蓝的溶液中:K+、CO32-、Na+、AlO2-
③水电离产生的c(H+)=10-12mol/L的溶液中:ClO- 、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、Cl-
A.①③ B.②④⑤ C.①②⑤ D.③⑥
6.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 molNO2在反应中转移的电子为4mol D.反应中NO2是还原剂
7.分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,在一定条件下与H2加成后的产物的一氯代物的同分异构体有( )
A.4种 B. 5种 C. 6种 D. 7种
8.恒温条件下,在醋酸钠溶液中分别加入少量下列物质:①固体NaOH ②固体KOH
③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸,可使c(CH3COO-)/c(Na+)比值一定增大的是( )
A.只有①② B.只有②⑤ C.只有①⑤ D.只有②④⑤
9.可逆反应: 3B(?)+C(?);ΔH>0,随着温度升高, 气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
3B(?)+C(?);ΔH>0,随着温度升高, 气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
A.B和C可能都是固体 B.B和C一定都是气体
C.B和C不可能都是气体 D.若C为固体,则B一定是气体
10.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32―+O2+xOH― Fe3O4+S4O62―
+2H2O,下列说法正确的是( )
A.x=2 B.参加反应的Fe2+全部做还原剂
C.每生成1mol Fe3O4,反应转移的电子总数为4mol
D.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
11.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的负极
C.电解质溶液中的阴离子向通氯气的电极移动
D.通氯气的电极反应为Cl2+2e―=2Cl―
12.pH=1的硫酸平均分成两份,一份加入水, 另一份加入与该硫酸浓度相同的NaOH溶液,pH都升高了1个单位,则加入的水和NaOH的体积比为( )
A. 6 B .
13.工业生产苯乙烯是利用乙苯的脱氢反应:

针对上述反应,在其它条件不变时,下列说法正确的是( )
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,不影响乙苯的转化率
C.在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
14.向 溶液中加入少量醋酸钠晶体或加等体积水时,都会引起( )
溶液中加入少量醋酸钠晶体或加等体积水时,都会引起( )
A.溶液的 增大
增大
B. 的电离平衡正向移动
的电离平衡正向移动
C.溶液的导电能力减小
D.溶液的酸性增强
15.下列有关离子方程式的书写正确的是( )
A.氨水中通入少量SO2气体: NH3?H2O +SO2 =NH4+ +HSO3―
B.Fe2O3固体溶于氢碘酸 : Fe2O3 + 6H+ = 2Fe3+ + 3H2O
C.浓烧碱溶液中加入铝片: Al+2OH― = AlO2―+H2 ↑
D.硫酸氢钠溶液与少量的氢氧化钡溶液混合:
2H++SO42―+Ba2++2OH― = BaSO4 ↓+2H2O
16.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:
A.负极反应为:14H2O+7O2+28e―=28OH―
B.放电一段时间后,负极周围的pH升高
C.理论上消耗1mol C2H6,电路上转移的电子为14mol
D.放电过程中,K+向负极移动
17. 下列叙述正确的是( )
A.0.01mol/L CH3COOH溶液与pH=12的NaOH溶液混合,若c(CH3COO―)>c(Na+),
则混合液一定呈碱性
B.常温下,将等体积0.01mol/L HCl与pH=12的氨水混合,则混合液的pH=7
C.0.1mol/L的二元弱酸盐Na
c(Na+)= 2[c(H
D.0.01mol/L NaHCO3溶液中
c(Na+)>c(HCO3―)>c(OH―)>c(H+)
18.某有机物分子中含有两个CH3―,一个―CH2―,两个 和两个―Cl,该有机物可能的结构简式有( )
和两个―Cl,该有机物可能的结构简式有( )
A.3种 B.4种 C.5种 D.6种
19.在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体且a>c,则下列说法正确的是( )
A.残余固体是铜和铁
B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀H2SO4中,有气泡产生
D.最后得到的溶液中可能含有Fe3+
20.某二元酸(H H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol?L?1的H
③ 0.02mol?L?1的HCl溶液与0.04mol?L?1的NaHA溶液等体积混合
④ 0.02mol?L?1的NaOH溶液与0.02mol?L?1的NaHA溶液等体积混合
下列关于上述四种溶液的说法不正确的是( )
A.溶液②中存在水解平衡:HA―+H2O H
H
B.溶液③中有:c(HA-)+ c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)浓度大小:③>①>②>④
 21.MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如右图所示。下列叙述中正确的是 ( )
21.MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如右图所示。下列叙述中正确的是 ( )
A.MOH和ROH都是强碱
B.稀释前,c(ROH)=
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,
所得溶液呈碱性
D.在x点,c(M+)=c(R+)
22.某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为3mol?L-1,则此溶液最多溶解铁粉的质量为( )
A.
23.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 0.10mol?L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
24.在一定温度下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应 xC(g),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是 ( )
xC(g),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是 ( )
A.若平衡时,甲、乙两容器中A的物质的量不相等,则x=3
B.平衡时,甲、乙两容器中A、B的物质的量之比不相等
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
 25.向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示。以下结论不正确的是( )
25.向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示。以下结论不正确的是( )
A.
A是盐酸,B是NaOH, 且c(NaOH) =
B. 原混合液中,c(Al3+): c(Mg2+):c(Cl-) = 1:1:5
C. A 是NaOH,B是盐酸,且c( NaOH) :c( HCl) = 2 : 1
D. 从6到9,相应离子反应方程式为H+ + OH- = H2O
二、选择题(每题有1个或2个正确答案,每题2分 共20分)
26、据央视报道,自
A.乙醇汽油是一种纯净物
B.乙醇汽油作燃料不会产生碳的氧化物等有害气体,其优点是可以减少对环境的污染
C.乙醇和汽油都可作溶剂,也可相互溶解 D.乙醇和乙二醇互为同系物
27、拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如右图:

下列对该化合物叙述正确的是( )
A、 属于芳香烃 B、属于卤代烃
C、苯环上的氢可以被取代 D、在一定条件下可以发生加成反应
28、已知一氯戊烷有8种同分异构体,可推知戊醇(属醇类)的同分异构体的数目是
A. 5种 B. 6种 C. 7种 D. 8种
29、可用分液漏斗分离的一组混合物是 ( )
A.溴乙烷和水 B.乙醇和丙三醇 C.乙醇和溴乙烷 D.乙醇和苯
30、下列物质与CH3CH2OH互为同系物的是( )

31、2―溴―3,3―二甲基戊烷是由某烃与等物质的量的溴化氢加成制取的,则原烃是( ) A. 3,3―二甲基―1―戊烯 B. 3,3―二甲基―2―戊烯
C. 3,3―二甲基―3―戊烯 D. 3,3―二甲基―4―戊烯
32.从溴乙烷制取1,2一二溴乙烷,下列转化方案中最好的是( )。

 |
 |
||
33、以1一氯丙烷为主要原料,制取1,2-丙二醇时,需要经过的各反应分别为( )
A.加成―消去―取代 B.消去―加成―取代
C.取代―消去―加成 D.取代―加成―消去
34、化合物X的分子式为C5H11Cl,用NaOH醇溶液处理X,可得到具有分子式为C5H10的两种产物Y、Z。Y、Z经催化加氢都可得到2-甲基丁烷.则X的结构简式为( )
A.CH3CH2CH2CH2Cl B.(CH3)2CHCHClCH3
C. (CH3)2CClCH2CH3 D. (CH3)3CCH2Cl
 35、
35、

( )
A.①和② B.②和③ C.②和④ D.③和④
第Ⅱ卷(非选择题 共60分)
三、非选择题
36. (8分)有A,B两种烃,氢的质量分数均为10%,烃A对氢气的相对密度为20,1mol烃A在一定条件下可与2mol氢气发生反应;烃B属于苯的同系物,当它与氯气反应时,不论在催化条件下还是在光照条件下都只生成3种一氯代物。
(1)写出A的结构简式________________________________。
(2)B的分子式为___________。
(3)写出B所有可能的结构简式______________________________________。
37.(10分)某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),其实验方案如下:

请回答下列问题:
(1)过滤用的玻璃仪器有______________________。
(2)写出由沉淀Ⅱ转化为AlCl3的离子方程式_______________________。
(3)小组成员经过检测,发现制得的绿矾不纯,原因可能是_____________,要想由沉淀Ⅰ最终制得纯度较高的绿矾,应如何改进_____________________。
(4)小组成员从资料中获知H2O2是一种绿色氧化剂,可以在滤渣B中加入稀硫酸和H2O2来制备胆矾晶体,则该反应的总化学方程式为_______________。
38.(12分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B中阴、阳离子个数比都是1∶1,但I中阴、阳离子个数比是2∶1,I常用作干燥剂。

请按要求填空:
⑴反应①的化学方程式
反应④化学方程式
⑵反应⑥的化学方程式____________________________
反应⑤的现象是____________________________________
⑶A的电子式是________________ ;L的电子式是__________。
 39.(18分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如右图。该实验的主要操作步骤如下:
39.(18分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如右图。该实验的主要操作步骤如下:
①配制浓度均为1 mol/L盐酸和醋酸溶液;
②检查装置的气密性;
③用________量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
④分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为;_________
⑤往乙中注入足量蒸馏水水,连接实验装置,将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录_________;
⑥反应结束后,待温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴写出镁与稀醋酸反应的离子方程式:_______________________。
⑵用文字表述②检查该装置气密性的操作与观察方法:____________。
(3)本实验中应选用__(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(4)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=______________________。
(5)简述速率不等的原因___________________________________
铜丝不与酸接触的原是_________________________________。
40. (12分)常温下往25mL稀硫酸中逐滴加入0.1mol/L氨水,溶液中水电离出的c(H+)浓度随滴入氨水的体积变化的曲线如下图所示
(1) 稀硫酸的浓度为____ mol/L;V1的值为____mL
(2) B点和D点溶液中的溶质分别是(填化学式)B点________D点____________
(3) E点溶液的pH值为__(填>7、<7、=7)
(4) 在V(NH3?H2O)从0到V2的变化过程中,不可能出现的离子浓度排序结果是_______
 A
A
B c(NH4+)>
C
D
E (NH4+)>c(SO42-)>c(H+)>c(OH-)
衡水中学2008-2009学年度第一学期期末考试
高二化学答案
1.B 前者有抗癌作用,后者没有抗癌作用,说明两者为不同物质,因此只能为平面结构。
2.B 金属单质还原性比较,即失电子能力的比较。
3.A A项,甲基:甲烷分子失去一个氢原子剩余的原子团,因此一个―CH3
含有9个电子。B项,Na2O2 中O22-
是一个整体,在1mol Na2O2中含有1mol阴离子。C项,标准状况下CHC13为液体。D项,根据电子守恒原理,原电池中导线上流过NA个电子时,正极放出H2为0?5mol , 标准状况下体积为
4.D 气态饱和烃:CnH2n+2 , n + (2n+2)/4 < 6.5,得n < 4
5.B ①HCO3―与OH-不能共存。③水电离的c(H+)=10-12mol/L的溶液,可能显酸性,也可能显碱性。⑥pH=0的溶液,Fe2+、NO3-、H+不能共存。
6.C HNCO和NO2 氮元素化合价分别为-3价和+4,都转化为0价,HNCO为还原剂,NO2 为氧化剂。1 molNO2在反应中转移的电子为4mol,正确。
7.B 分子式为C7H8的某有机物,能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,该有机物为甲苯,与H2加成后的产物为甲基环己烷,它的一氯代物有5种。
8.D CH3COONa稀溶液,存在平衡:CH3COO- + H2O  CH3COOH + OH-
。加酸平衡正向移动,加碱平衡逆向移动。
CH3COOH + OH-
。加酸平衡正向移动,加碱平衡逆向移动。
9. D
10.C 根据离子方程式两边电荷守恒,配平得χ=4,每生成1mol Fe3O4,反应转移的电子总数为4mol;1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/4mol。
11.C 氢气、氯气反应制盐酸设计成原电池,总反应:H2 + Cl2 = 2HCl ,负极:H2 - 2e- = 2H+ ,正极:Cl2+2e―=2Cl― ,阴离子向负极移动。
12.A
13.D 加入乙苯至达到平衡过程中,混合气体的物质的量增大,平均相对分子质量在不断减小。
14.A 加入醋酸钠晶体,平衡逆向移动,c(H+)减小,c(OH-)增大;加水时,平衡正向移动,但c(H+)却减小,则c(OH-)增大。
15.D A项应生成SO32-;B项Fe3+会氧化I―;C项电荷不守恒
16.C 负极反应为:C2H6 -14 e― +18OH―=2CO32―+12H2O。K+应向正极移动
17.D A项据电荷守恒,应呈酸性;B项氨水过量,应呈碱性;C项中c(A2-)前的2去掉。
18.D
19.B 据a>c,Cu2+不可能被铁反应完,铁也不可能有剩余,则有Cu2+剩余;有残留固体则不可能有Fe3+剩余。
20.A 由电离方程式可知,H
21.D 由图可知MOH为弱碱,ROH为强碱,所以C项应为酸过量,呈酸性;由于碱性不同,二者浓度不为10倍关系;D项据电荷守恒可知。
22.B 设未知数可求原溶液中n(Fe3+),据电荷守恒可求加入的铁粉量。
23.C A项中还有HCO3―;B项中据质子守恒,c(H+)还包括HCO3―电离产生的;D项醋酸消耗多。
24.D 若要体积分数都为0.2,x可为2或4,平衡时各物质的体积分数相同(A为60%)。x=2时甲、乙中的平衡状态完全相同(A的物质的量、容器中压强);x=4时甲乙中A的物质的量、容器中压强不相等。
25.A 由图可知A为NaOH,B为盐酸;c(Mg2+):c(Al3+)=1:1,c(NaOH):c(HCl)=2:1.
26.C
27.CD 28.D
36.(1)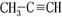 (2分)(2)C9H12 (2分) (3)
(2分)(2)C9H12 (2分) (3) (2分)
(2分)  (2分)
(2分)
37.(1)烧杯、漏斗、玻璃棒(2分) (2)Al(OH)3+3H+ = Al3++3H2O(2分)
(3)反应过程中部分亚铁离子转化成了三价铁离子(2分) 向溶液D中加入足量铁粉,反应后过滤,取滤液浓缩结晶即可得绿矾(2分)
(4)Cu+H2O2+H2SO4+3H2O = CuSO4?5H2O(2分)
38.(1)CaC2+2H2O=C2H2 +Ca(OH)2(2分)
+Ca(OH)2(2分)
Ca(OH)2+2NH4Cl CaCl2+2NH3+2H2O(2分)
CaCl2+2NH3+2H2O(2分)
(2)CO2+Ca(ClO)2+H2O=2HClO+CaCO3(2分)
在空气中燃烧,火焰明亮并伴有浓烈的黑烟(2分)
(3)
 (各2分)
(各2分)
39.③酸式滴定管(2分);④ 0.12(2分);⑤反应起止时间(2分);
(1) Mg+2CH3COOH=Mg2++2CH3COO―+H2 (2分)
(2分)
(2) 往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气。(以下方案错误:往乙中加水,然后用两手掌紧贴甲外壁一会儿,乙右侧导管中液面上升。因为不能确定连接丙的导管是否漏气。)(2分)
(3) B(2分); (4)0.2V L/mol(2分);
(5)酸的浓度相同时,c(H+)不同(2分);
防止形成原电池,干扰实验现象的观察(2分)。
40. (1)0.05, 25
(2) H2SO4与(NH4)2SO4, (NH4)2SO4与NH3?H2O
(3)=7
(4)BC (每空各2分)