分散系 胶体
考点聚焦
1.知道根据分散质粒子的大小,把分散系分为溶液 、胶体和浊液
2.了解溶液、悬浊液、乳浊液的涵义。
3.了解溶液的组成,溶液形成过程,溶质溶解时的吸热和放热现象;理解溶液中溶质的质量分数的概念。
4.了解饱和溶液、不饱和溶液的概念,知道温度对溶解度的影响及溶解度曲线。
5. 了解胶体的概念及其重要性质和应用。
6. 知道用丁达尔效应区分溶液和胶体。
知识梳理
一、溶液的有关概念
1.溶液:一种或几种物质 到另一种物质里,形成 、 的混合物。
溶液由 、 组成。
2.饱和溶液:一定 下,一定量溶剂中不能 的溶液。溶液是否饱和是相对的,改变 、 、 等因素,不饱和溶液与饱和溶液可以相互转变。
3.溶质的质量分数:用 溶液中所含溶质的 表示的浓度。
溶质的质量分数通常用ω表示,其数学表达式为 : 。
配制一定溶质的质量分数的溶液的操作步骤为① ② ③ 。现欲配制
、 、 (必要时需注明仪器规格)。
4.固体溶解度:一定温度下,某物质在
一般用固体物质在
易溶 ,可溶 ,微溶 ,不溶 。
5.溶解度曲线: 。
(1)溶解度曲线上的点表示物质 ,溶液所处的状态 。
(2)溶解度曲线下面的的点,表示溶液所处的状态是 状态。
(3)溶解度曲线上面的点,依其数据配制的溶液为对应温度时的 溶液,且该溶质有剩余。
 (4)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的 相等。
(4)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的 相等。
如:右图为硝酸钾和氯化钠的溶解度曲线。由图可知:
①当温度______时,硝酸钾与氯化钠的溶解度相等。
②当温度______时,氯化钠的溶解度大于硝酸钾的溶解度。
③图中P点表示KNO3对应的溶液是______
④当温度为
6.结晶: 。结晶水合物: 。结晶水合物容易失去结晶水,常见的结晶水合物有:
如胆矾( )、绿矾( )、明矾( )、石膏( )、芒硝( )等。
7.风化与潮解
(1)风化:
。
①本质:结晶水合物分解。
Na2CO3?10H2O=Na2CO3十10H2O
(无色晶体) (白色粉末)
②现象:
。
(2)潮解:
。 易潮解的物质有:CaCl2,MgCl2,NaOH等。
①粗盐易潮解,而精盐不易潮解。这是因为
。
②一小块NaOH固体露置在空气中,会逐渐地
→
→
。这是因为
。
③因为NaOH易潮解,所以用它作干燥剂时常与CaO混合制成碱石灰,以防其潮解。
思考:下列说法是否正确?若不正确,请说明理由。
(1)溶解是一个物理变化过程,溶解过程中没有明显的能量变化。
(2)饱和溶液不一定是浓溶液,但不饱和溶液一定是稀溶液,所以饱和溶液的质量分数一定大于不饱和溶液。
(3)气体的溶解度随温度升高而减小,固体溶解度随温度升高而增大。
(4)某温度下,将一块氯化铵晶体投入饱和的氯化铵溶液中,氯化铵晶体不会发生任何变化。
(5)一定温度时,有晶体析出的溶液一定是饱和溶液。
二、溶液的有关计算
有关溶液的计算,除了必需掌握溶解度S、溶质的质量分数ω的计算公式外,还必需掌握饱和溶液中,溶解度S、溶质的质量分数ω、物质的量浓度c之间的换算关系:
三、胶体
1.胶体的概念:分散质直径在 之间的分散系。胶体粒子不能通过 ,但能通过 。所以分离胶体与溶液的方法是 。
2.胶体的性质:胶体的性质主要为 运动、 现象和 。
3.胶体的制备:将少量饱和的氯化铁溶液加入沸水中,可制备氢氧化铁胶体。反应方程式如下: 。
思考:各举一例说明胶体特性的应用:
(1)丁达尔效应 (2)电泳现象
(3)不能透过半透膜 (4)吸咐性
四、分散系
1.概念:一种或几种物质分散到另一种物质中形成的混合物叫做分散系。被分散的物质叫做 ,物质分散于其中的物质叫做 。
2.分散系的比较
分散系
种类
溶液
胶体
浊液
水溶液
非水溶液
粒子胶体
分子胶体
悬浊液
乳浊液
分散质粒子
离子或分子
分子
分子或离子的集合体
大分子
巨量分子集合的颗粒
巨量分子集合的液滴
举例
食盐水
碘酒
Fe(OH)3胶体
淀粉溶液
石灰乳
牛奶
分散质粒子直径⑴
1n m
1nm~100n m
100n m
均一性⑵
稳定性⑶
久置沉降
久置分层
能否通过滤纸⑷
能否通过半透膜⑸
有无丁达尔效应⑹
―
试题枚举
【例1】右图是M、N两种不含结晶水的固体物质的溶解度曲线。下列说法中正确的是
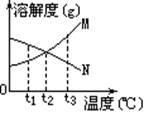 A.t
A.t
B.温度从t
C.M比N的溶解度大
D.N中含有少量M时,可用降温结晶法提纯N
解析:由图可看出,t
答案: A
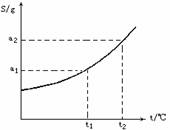 【例2】摩尔质量为M g/mol的某物质的溶解度曲线如图所示,现有t
【例2】摩尔质量为M g/mol的某物质的溶解度曲线如图所示,现有t
解析:由溶解度曲线可知,在t2时,该物质的溶解度为a
饱和溶液的溶质质量关分数可用下式计算: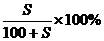
再根据物质的量浓度和溶质质量分数的换算公式,求出溶液的物质的量浓度。
由t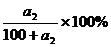 。
。
溶液的物质的量浓度=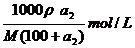
设降温至t1时,析出的晶体的质量为χ
 根据公式:100+S(高温)∶S(高温)-S(低温)=高温下饱和溶液质量∶析出晶体质量
根据公式:100+S(高温)∶S(高温)-S(低温)=高温下饱和溶液质量∶析出晶体质量
(100 +a2)∶(a2-a1)=(300-50)∶χ
χ=250(a2-a1)/(100+a2)g
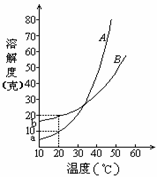
【例3】A、B两种化合物的溶解度曲线如右图。现要用结晶法从A、B混和物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取
(2)取W克混和物,将它溶于
当W<a+b时,A%
当W>a+b时,A% 。
解析:(1)因为在
(2)要使B不析出,B的质量≤b,而A要析出,A的质量应>a。当W<a+b时,只要A>a,即可满足条件,所以A%>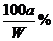 。当W>a+b时,B≤b即可满足条件,所以A%≥
。当W>a+b时,B≤b即可满足条件,所以A%≥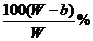
【例4】氯化铁溶液和氢氧化铁胶体具有的共同性质是( )
A.分散系颗粒直径都在1~100nm之间
B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成
D.呈红褐色
解析:溶液中溶质颗粒直径都小于1nm,胶体中胶粒直径都在1~100 nm之间,前者能透过半透膜,后者不能透过半透膜。加热蒸干时,氯化铁水解为氢氧化铁,灼烧后,氢氧化铁分解为氧化铁,氧化铁溶液呈棕黄色,氢氧化铁胶体呈红褐色。
答案:C