电解池两极三判断
江苏 倪洪海
解答电解原理及其应用的有关问题,一般的思路是先确定电解池的阴、阳两极,再分析溶液中阴、阳离子的放电顺序,最后写出相应的电极反应式。而确定电解池两极是解题的切入点,那么如何确定电解池的两极呢?下面简要介绍常用的方法。
一、根据电子移动方向或电流方向判断
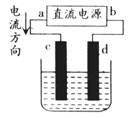
A、a为正极、b为负极
B、a为阳极、b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
解析 电解时,电流的流向是:电源正极→电解池阳极,电解池阴极→电源负极。从图中可以看出,a为正极,b为负极,c为阳极,d为阴极。电极反应式分别为阳极:2Cl--2e-=Cl2↑;阴极:Cu2++2e-=Cu。所以电解过程中,c极有气体(Cl2)析出,溶液中的氯离子浓度降低;d极有固体(Cu)析出,质量增加。
答案 AC
电解池的阳极反应是电极本身或电解质溶液中的阴离子失去电子,发生氧化反应;阴极反应是溶液中阳离子得到电子,发生还原反应。根据电极产物逆向推理可得出电解池的阴、阳两极及电极反应。
例2 下图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是( )。
二、根据电极反应判断

a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
解析 a极板质量增加,是由于不活泼金属阳离子在a极板上得到电子被还原,所以a极板作阴极,b极板作阳极,X为电源的负极,Y为电源的正极。b极板处(阳极)放出无色无味的气体,则b极材料不可能是活泼金属,可能是石墨,溶液中的OH-放电,产生O2。综合分析,只有A项符合题意。
答案 A
例3 近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,KI溶液为电解液在一定条件下电解,反应式为:KI+3H2O==KIO3+3H2↑。下列有关说法中,正确的是( )。
A、电解时,石墨作阴极,铁作阳极
B、电解时,在阳极上产生氢气
C、电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
三、根据反应原理判断
D、电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
解析 电解时,若用铁作阳极,则是铁先失去电子,故石墨作阳极,铁作阴极;阴极反应式为2H++2e-=H2↑,阳极反应式为I-+6OH--6e-==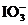 +3H2O,所以电解时,阴极上产生氢气;KIO3能溶于水,故要得到KIO3产品的第一步不应该是过滤;根据电解总反应式可知,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体。
+3H2O,所以电解时,阴极上产生氢气;KIO3能溶于水,故要得到KIO3产品的第一步不应该是过滤;根据电解总反应式可知,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体。
答案 D