广东省普宁市华南学校九年级2008~2009学年第二学期
3 月 份 月 考 化 学 试 卷
化 学 试 卷
说明:答题时间90分钟,满分100分
题号
一
二
三
四
总分
得分
可能用到的相对原子质量:H
一、 识别与选择(每小题只有一个选项符合题意,请将其字母标号填在下表相应的空格内。
1.人类生活需要能量。下列能量转化的例子中不是由化学变化产生的是
A.燃起篝火烘烤食物 B.太阳能热水器烧水
C.绿色植物将太阳能转化为化学能 D.煤燃烧发电
2. 下列各组物质中,都属于混合物的是
A.石灰水、水 B.干冰、冰水混合物
C.石墨、铁矿石 D.不锈钢菜刀、食用醋
3.物质的下列性质中,属于化学性质的是
A.颜色、状态、气味 B.密度、硬度、延展性
C.熔点、沸点、挥发性 D.还原性、可燃性、活泼性
 4.下列实验操作正确的是
4.下列实验操作正确的是
A B C D
5.某全麦饼干部分营养成分的含量如下表所示,表中的“铁、镁、锌、钙”是指
营养成分
铁
镁
锌
钙
含量(mg/
4.5~5
90~100
3~4
280~300
A.分子 B.原子 C.元素 D.离子
6.一杯
A.蒸发
C.把溶液降温至
7.下列说法正确是
A.生铁会完全溶解在盐酸里
B.铁矿石用于炼铁是因为铁矿石中含有大量单质铁
C.铁丝在氧气中燃烧生成氧化铁
D.盛水的铁桶最易生锈的部位是水面附近
8.根据你的生活和学习经验判断,下列做法错误的是
A.用金、银、铜作货币金属 B.用干冰制造舞台上的云雾
C.铁制品表面涂油漆防锈 D.用燃着的火柴检验煤气是否泄露
9.室温下,一杯饱和食盐水露置在空气中一段时间,有少量晶体析出,是因为
A.氯化钠的溶解度变小 B.溶液中溶质质量分数变小
C.溶剂质量减小 D.溶液变成不饱和溶液
10.用固体硝酸钠配制溶质质量分数一定的溶液时,正确的操作顺序是
A.称量、量取、溶解、计算 B.溶解、计算、称量、量取
C.计算、称量、量取、溶解 D.称量、量取、计算、溶解
11.下列反应不属于置换反应的是
A.Fe+H2SO4 == FeSO4+ H2↑ B.C+2CuO 高温 2Cu + CO2↑
C.H2 + CuO △ Cu + H2O D.CO + CuO △ Cu + CO2
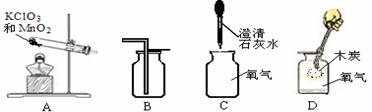
12.下图一次是实验室制取、收集、检验氧气和验证其性质的装置。其中错误的是
13.上海医疗器械厂科研人员研制成不用电的化学冰箱,其原理是将一种物质溶解于水时的吸热作用作冷源,达到降温目的。这种物质可能是
A.食盐 B.氢氧化钠 C.硝酸铵 D.熟石灰
14.如要将
A.
15.下列四种物质中,有一种物质在适当条件下能与其他三种物质反应,这种物质是
A.氧气 B.铁 C.盐酸 D.硫酸铜溶液
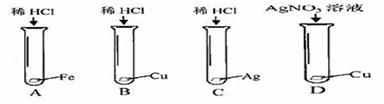 16.为验证Fe、Cu、Ag三种金属的活动性是依次减弱的,某化学兴趣小组设计了下图的四个实验。其中不必进行的是
16.为验证Fe、Cu、Ag三种金属的活动性是依次减弱的,某化学兴趣小组设计了下图的四个实验。其中不必进行的是
17.下列说法正确的是
A.固体物质的溶解度都随温度的升高而增大
B.饱和溶液降低温度时都能够析出晶体
C.一定温度时,将
D.某温度下,在KNO3的饱和溶液中加入食盐,若温度不变,则食盐不溶解
18.X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是:
① Z + YSO4 = ZSO4 + Y ② X + YSO4 = XSO4 + Y
③ Z + H2SO4 =ZSO4 +H2↑ ④ X + H2SO4不发生反应
A.Z>X>Y B.Z>Y>X C.X>Y>Z D.X>Z>Y
19.下列关于金属资源的说法中,你不赞成的是
A.地球上除少数不活泼金属如金、银等有单质形式存在外其他都以化合物形式存在
B.地球上的金属资源是取之不尽的
C.防止金属锈蚀、回收利用废旧金属可以保护金属资源和环境
D.合理开采矿物、寻找金属代用品都是保护金属资源的有效途径
20.碳酸氢钠用于焙制糕点,在
A.
二、分析与表达(化学方程式2分,其余每空1分,共35分)
21.学习化学,我们接触到了许多国际通用的化学用语,它们是我们学习化学的工具。请你用化学符号填空:⑴ 二个氢原子 ; ⑵ 一个氮分子 ;
⑶三个钠离子_____ ___; ⑷ 四个二氧化碳分子______ ______。
22.(1)写出下列溶液中溶质的化学式:①食盐水 ;②稀盐酸 ;③大理石和盐酸恰好完全反应后所得溶液中的溶质 。
(2)现有一瓶
23.在家庭生活中,自来水经过处理后,用途更加广泛。
(1)净水器可以净化自来水,获得更优质的饮用水。①净水器中装有活性炭,其作用是________________;②净水器接通电源时产生紫外线与自来水生产中加氯气的目的相同,其作用是________________。
(2)用自来水养金鱼时为除去其中少量的余氯,可放入少许大苏打(化学式为Na2S2O3?5H2O)。大苏打由___________种元素组成,其中硫元素的化合价为__________。
(3)水溶液在生产,生活中有着广泛的应用。冬天在汽车的水箱中加入少量乙二醇,可使水溶液的凝固点_____________,以防止水结冰。
24.镁、铁、铝在日常生活中都有较广泛的用途。如:
(1)镁在空气中燃烧时,能发出耀眼的白光,可用来制造镁闪光灯,该反应的化学方程式为 ,该反应的基本类型是 。
(2)市场上出售的补血麦片中常含有微量颗粒细小的还原性铁粉,铁粉与人体胃液中的盐酸发生反应转化为氯化亚铁,起到补血的作用,写出这个反应的化学方程式 。

 (3)铝常用于制作炊具,主要利用它的
性。常温下铝是一种活泼的金属,但铝却有较强的抗腐蚀性,其原因是
。另外,铝制容器不能盛放波尔多液(主要成分是硫酸铜),其原因是(用化学方程式表示)
。
(3)铝常用于制作炊具,主要利用它的
性。常温下铝是一种活泼的金属,但铝却有较强的抗腐蚀性,其原因是
。另外,铝制容器不能盛放波尔多液(主要成分是硫酸铜),其原因是(用化学方程式表示)
。
25.医生给病人输液时,常用葡萄糖注射液。右图为葡萄糖注射
液的部分标签图,根据右图回答下列问题:
(1) 从该溶液中取出10mL,则取出溶液中溶质的质量分数______________;
(2)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共
补充葡萄糖__________g。
(3)如果从瓶中取出
26.铁锅的使用在我国家庭中十分普遍,但铁锅经常因为生锈而破损。据你观察,铁锅生锈的条件是 。你认为在日常生活中防止铁锅生锈可以采取的措施是 。

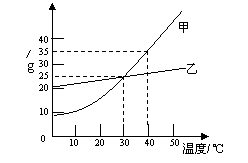 27.右图是甲、乙两固体物质的溶解度曲线图,看图后回答下列问题:
27.右图是甲、乙两固体物质的溶解度曲线图,看图后回答下列问题:
(1)
(2)
(3)
(4)两条曲线相交的含义是 ___________________________________________。
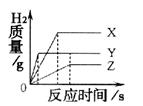 28.把相同体积、相同质量分数的稀盐酸,分别滴到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中,生成H2的质量与反应时间的关系如右图所示。这三种金属的活动性顺序为
;假如X、Y、Z都是+2价金属,则相对原子质量由大到小的顺序为
。
28.把相同体积、相同质量分数的稀盐酸,分别滴到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中,生成H2的质量与反应时间的关系如右图所示。这三种金属的活动性顺序为
;假如X、Y、Z都是+2价金属,则相对原子质量由大到小的顺序为
。
三、实验与探究(化学方程式2分,其余每空1分,共16分)
29.下图是实验室用一氧化碳还原氧化铁的实验装置图,试回答:

(1)仪器③的名称是 ,在上述装置中的作用是_______________________
________________________,有关反应的化学方程式是___________________________。
(2)实验过程中仪器①中的现象是 ,
反应的化学方程式是_____________________________________________________,
能证明产物中有铁粉的方法是______________________________________________。
(3) 仪器②中发生反应的化学方程式是 。
30.为了探究铁和铜的金属活动性强弱,请根据实验室现有的仪器和药品条件(如下所列),通过填写下表,完成对实验方案的构思。
【实验仪器】试管、胶头滴管、镊子
【实验药品】铁钉、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液
方案
所选药品
有关化学方程式
1
2
四、信息与计算(31题4分,32题5分,共9分)
31.某钢铁厂日产含杂质4%的生铁2240 t。问: 需要含Fe2O380%的赤铁矿石多少吨?
32.市场上有两种外观类似黄金的Cu―Zn合金和Cu―Ag合金制品,若实验室只提供一瓶稀硫酸和必要仪器。
(1) 你认为能测出 合金中铜的质量分数;
(2) 取上述(1)中的合金粉末
求:①产生氢气的质量;
②求出该合金中铜的质量分数;
③稀硫酸中溶质的质量分数。
广东省普宁市华南学校九年级2008~2009学年第二学期
3 月 份 月 考 参 考 答 案
题号
1
2
3
4
5
6
7
8
9
10
答案
B
D
D
C
C
B
D
D
C
C
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
C
C
B
C
C
A
B
B
二、21. 2H N2 3Na+ 4CO2
22.(1) ① NaCl ②HCl ③ CaCl2 (2) 蒸发溶剂、 增加溶质等
23.(1)①吸附 ②杀菌消毒 (2)4 +2 (3)降低
24.(1)2Mg+O2 点燃 2MgO 化合反应
(2)Fe+2HCl=FeCl2+H2↑
(3)导热 常温下铝和氧气反应,表面生成致密的氧化物薄膜,从而阻止铝进一步氧化。
2Al+3CuSO4= Al2(SO4)3+3Cu
25.(1)5% (2)
26.有空气和水共同存在时 保持铁锅表面干燥
27.(1)
28.Y>X>Z Z>Y>X
2CO+O2 点燃 2CO2
三、29.(1)酒精灯 点燃一氧化碳,防止未反应的一氧化碳排放到空气中污染环境
(2)固体由红色变黑色 3CO+Fe2O3 2Fe+3CO2 用磁铁吸引
2Fe+3CO2 用磁铁吸引
(3) Ca(OH)2 +CO2===CaCO3↓+H2O
方案
所选药品
有关化学方程式
1
铁钉、铜片、稀硫酸
Fe+H2SO4 == FeSO4+H2↑
2
铁钉、硫酸铜溶液
Fe+CuSO4 == FeSO4+Cu
30.
31.3840 t
32.(1)Cu―Zn (2)0.2 67.5% 19.6%