题目内容
【题目】
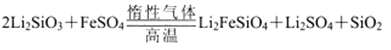
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
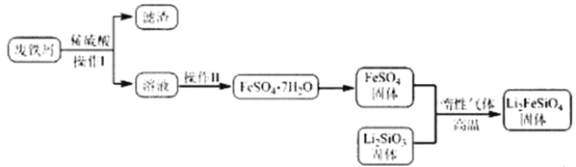
实验(二)Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol.L-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中仪器名称:仪器B ,仪器C .
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是__________。
(3)操作Ⅱ的步骤___________,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需_______________。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
【答案】(1)100ml容量瓶 酸式滴定管
(2)要防止二阶铁离子被氧化
(3)蒸发浓缩,降温结晶,过滤 玻璃棒
(4)SO2+2Fe3+ + 2H2O=2Fe2++SO42-+4H+;除去过量的SO2,以免影响后面Fe2+的测定
(5)溶液变为浅红色,且半分钟内不变色 81.0% 偏高
【解析】(1)实验二中仪器B是100ml容量瓶,其内含有100mL溶液。硫酸是强酸,所以仪器C是酸式滴定管。
(2)为了防止二阶铁离子被氧化,制备Li2FeSiO4时必须在惰性气体氛围中进行。
(3)操作Ⅱ为蒸发浓缩,降温结晶,过滤,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需玻璃棒。
(4)若还原剂A可用SO2,则反应式为SO2+2Fe3+ + 2H2O=2Fe2++SO42-+4H+;后续处理的主要目的是除去过量的SO2,以免影响后面Fe2+的测定。
(5)滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81.0%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高。