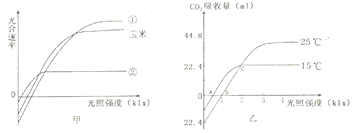
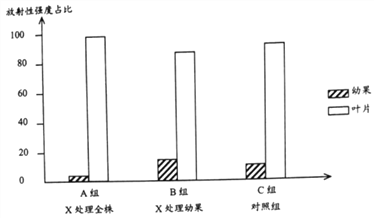
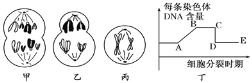
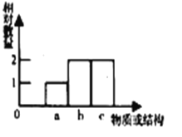
题目内容
【题目】某饱和一元醇与足量金属钠反应得到0.5gH2,取相同物质的量的该醇完全燃烧后得36g水.该醇应是
A.乙醇(C2H6O)B.丙醇(C3H8O)
C.丁醇(C4H10O)D.丙三醇(C3H8O3)
【答案】B
【解析】
醇和钠反应,生成氢气,实际反应的方程式是2ROH+2Na=2RONa+H2,0.5gH2的物质的量0.25mol,是根据方程式醇的物质的量就是0.25×2=0.5mol,36g水的物质的量是2mol中含有4mol氢原子,即1个醇分子中含有8个氢原子,且为饱和一元醇,满足条件的应该是丙醇。
故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目