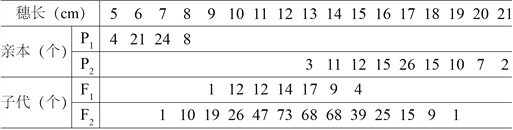
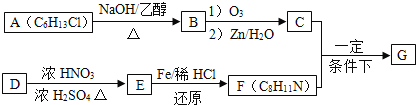
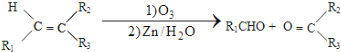题目内容
【题目】0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)通过计算推断该有机物的化学式。
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。
【答案】C2H6O2 ![]()
【解析】本题分析:本题主要考查有机物的组成与结构。
(1)浓硫酸吸水10.8g即0.6mol,含有1.2molH、0.6molO。CuO~CO~Cu,CuO质量减轻3.2g即减少0.2molO,对应消耗0.2molCO。碱石灰质量增加17.6 g即吸收0.4mol CO2,其中0.2mol由CO转化而来,所以燃烧产生0.2mol CO2。有机物含氧0.6mol+0.2mol+0.2mol×2-0.4mol×2=0.4mol。因此有机物的化学式为C2H6O2。
(2)0.2 mol该有机物恰好与4.6 g即0.2mol金属钠完全反应,说明该有机物分子含有一个羟基,有机物的结构简式为![]() 。
。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】(14分)乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
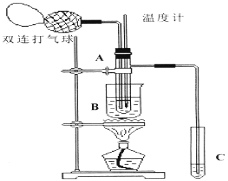
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) ;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在_____,目的是_____________________________;
(3)烧杯B的作用是__________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为 。