下列实验操作和理象、结论均正确且有因果关系的是
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色 | 原溶液中含有I- |
B | 常温下,0.1mol/LNaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
C | 相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH | 亚硫酸的酸性强于碳酸 |
D | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色 | 稀HNO3将Fe氧化为Fe2+ |
A. A B. B C. C D. D
硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,图示如下:

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
则反应I的△H=_______kJ/mol。反应Ⅲ的化学方程式为__________________。
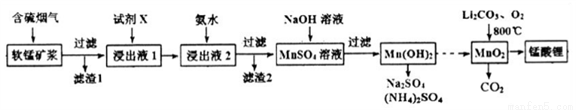
(2)从废钒催化剂中回收V2O5的过程如下:

①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式_________。
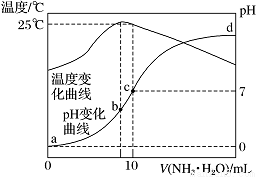
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为________[25℃,Ksp(NH4VO3) =1.6×10-3,溶液体积变化忽略不计]。
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,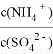 将_______(填“变大”、“不变”或“变小”)。
将_______(填“变大”、“不变”或“变小”)。
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
=_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
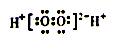

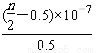




 LiMn2O4+C(x<1)
LiMn2O4+C(x<1)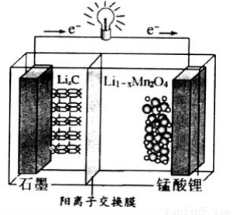
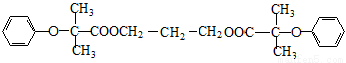

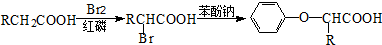
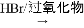 RCH2CH2Br
RCH2CH2Br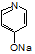 (
( 与苯环性质相似)与
与苯环性质相似)与 苯合成
苯合成 的路线______________。
的路线______________。