在给定的条件下,下列选项所示的物质间转化均能实现的是
A. H2SiO3 SiO2
SiO2 SiCl4 B. 浓HCl
SiCl4 B. 浓HCl Cl2
Cl2 漂白粉
漂白粉
C. Fe Fe2O3
Fe2O3 FeCl3 D. Mg(OH)2
FeCl3 D. Mg(OH)2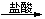 MgCl2(aq)
MgCl2(aq) 无水MgCl2
无水MgCl2
根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向PH=3的HA和HB溶液中分别加水稀释至100倍,pH(HA)>pH(HB) | 酸性:HA<HB |
B | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向FeBr2溶液中通入少量Cl2,溶液由浅绿色变为黄色 | 氧化性:Cl2>Br2 |
D | 向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
A. A B. B C. C D. D
一定温度下,向3个初始体积均为1.0 L的密闭容器中按下表所示投料,发生反应N2(g)+3H2(g) 2NH3(g) △H<0达到平衡,下列说法错误的是
2NH3(g) △H<0达到平衡,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量/mol | 反应物的转化率 | 平衡时NH3的物质的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 绝热恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒温恒压 | 2 | 6 | 0 | α3 | b |
A. 达到平衡时,α1>α2
B. 平衡时NH3的物质的量b<2.4
C. 达到平衡时,容器Ⅱ中的反应速率比容器Ⅰ中的大
D. 保持温度不变,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol  NH3,平衡向正反应方向移动
NH3,平衡向正反应方向移动
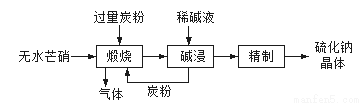
湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:
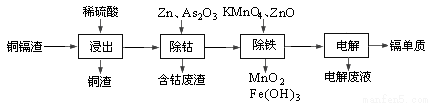
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。

 CH3OH(g)。该反应的△H=-91.kJ·mol-1
CH3OH(g)。该反应的△H=-91.kJ·mol-1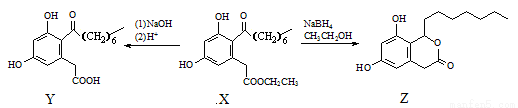

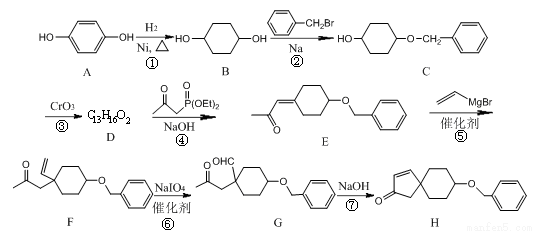
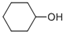 为有机原料制备
为有机原料制备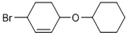 的合成路线流程图(无机试剂任用,可选择适当有机溶剂,合成路线流程图示例见本题题干)___________________。
的合成路线流程图(无机试剂任用,可选择适当有机溶剂,合成路线流程图示例见本题题干)___________________。