某学习小组利用反应:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O H2C2O4来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是______(填序号)。
A.可能明显加快 B.可能明显减慢 C.几乎无影响,可以忽略
(2)甲同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
B | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①探究温度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
②实验a测得混合后溶液褪色的时间为40%,忽略混合前后 体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______。
(3)在其它条件相同的情况下,乙同学用不同浓度的KMnO4酸性溶液实验,测得实验数据如下表所示:
实验编号 | 温度℃ | H2C2O4溶液 | KMnO4酸性溶液 | 褪色的时间(min) | |||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
1 | 25 | 0.10 | 4 | 0.2 | 8 | t1 | |
2 | 25 | 0.010 | 4 | 0.2 | 8 | t2(t2<t3) | |
依据表中数据,_____(填“能”或“不能”)得出“溶液褪色所需时间越短,反应速率越快”的结论,理由是__________________。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①同学们据此提出以下假设:
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:反应生成的K+或SO42-该反应有催化作用
丙同学认为假设3不合理,其理由是__________。
②丁同学用如下实验证明假设2成立:在A和B两支试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入1mL蒸馏水,然后在两支试管中同时分别加入1mLO.1mol·L-1KMnO4酸性溶液,A试管溶液褪色的时间明显早于B试管。在B试管中加入1mL蒸馏水的目的是:__。
③同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)_______________。
发展以煤制乙烯、丙烯、丁烯等低碳烯烃,部分替代石油化工产品的道路是我国保障能源安全战略的重要措施。间接法是先由煤制合成气(组成为H2、CO和少最的CO2)制备甲醇或二甲醚(CH3OCH3),其主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.1 kJ•mol-1
CH3OH(g) △H1=-90.1 kJ•mol-1
②CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H2=-49.0kJ•mol-1
CH3OH(g) +H2O(g) △H2=-49.0kJ•mol-1
水煤气变换反应:
③CO(g)+ H2O(g) CO2(g)+ H2(g) △H3=-41.1kJ•mol-1
CO2(g)+ H2(g) △H3=-41.1kJ•mol-1
二甲醚合成反应:
④2CH3OH(g) CH3OCH3(g)+H2O(g) △H4=-24.5kJ•mol-1
CH3OCH3(g)+H2O(g) △H4=-24.5kJ•mol-1
回答下列问题:
(1)分析上述反应(均可逆),发生反应④对于CO转化率的影响是_______(填“增大”、“减小”或“无影响”,其理由是__________。
(2)在二个体积均为1.0L的恒容密闭容器中发生上述二甲醚合成反应④。实验数据见下表:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
①387℃时,反应④的化学平衡常数K=__________。
②达到平衡时,容器b中CH3OH的转化率为________。
③达到平衡时,容器c中CH3OCH3的体积分数为________。
(3)由H2和CO可直接制备二甲醚:2CO2(g)+4H2(g)=CH3OCH(g)+H2O(g) ΔH=__________;为提高反应物的转化率,根据化学反应原理,理论上应采取的措施是________(填序号)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
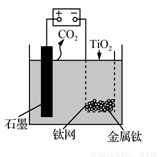
(4)有研究者用Cu-Zn-Al和Al2O3作催化剂,压强为5.0 MPa的条件下,由合成气[ =2]直接制备二甲醚,结果如下图所示.已知:选择性=
=2]直接制备二甲醚,结果如下图所示.已知:选择性= ×100%。则有图可知二甲醚的选择性达最大值时对应的温度是____________。
×100%。则有图可知二甲醚的选择性达最大值时对应的温度是____________。
(5)2016年,我国的两个科研团队在合成气直接制备低碳烯烃(nCO+2nH2 CnH2n+nH2O)的研究中连续取得重大突破,论文分别发表在《德国应用化学》(2016.03.16)、《Nature》(2016.10.06)杂志上。
CnH2n+nH2O)的研究中连续取得重大突破,论文分别发表在《德国应用化学》(2016.03.16)、《Nature》(2016.10.06)杂志上。 =2时,前者在400℃,1MPa的条件下,CO转化率为11%,低碳烯烃选择性达74%;后者在250℃,0.1~0.5MPa的条件下,CO转化率为31.8%,低碳烯烃选择性为60.8%,则其中低碳烯烃的产率较大者的值为_________。
=2时,前者在400℃,1MPa的条件下,CO转化率为11%,低碳烯烃选择性达74%;后者在250℃,0.1~0.5MPa的条件下,CO转化率为31.8%,低碳烯烃选择性为60.8%,则其中低碳烯烃的产率较大者的值为_________。
【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____g•cm-3。

一定条件下,下列各组物质之间不能通过一步反应实现如图所示转化关系是

选项 | X | Y | Z | W |
A | Mg | Mg3N2 | MgCl2 | Mg(OH)2 |
B | Al | NaAlO2 | Al(OH)3 | AlCl3 |
C | N2 | HNO3 | NO | NO2 |
D | NaCl | Cl2 | HCl | HClO |
A. A B. B C. C D. D

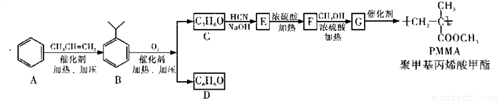

 —CH2CH2OH)为原料(无机试剂任选),设计制备肉桂酸(
—CH2CH2OH)为原料(无机试剂任选),设计制备肉桂酸(