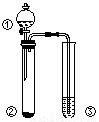
利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g )
)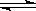 M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法不正确的是:
A.实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L·min)
B.实验②中,该反应的平衡常数K=12.5
C.实验②中,达到平衡时,a大于0.16
D.正反应为放热反应
在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
(1)△H ____________ 0(填“<”或 “>”)。
(2)830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)判断该反应是否达到平衡的依据为
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为 。
某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。小组同学先进行理论预测,提出如下三种可能:
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生 反应
c.Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式
(2)将预测b补充完整 ,说明预测依据 。
在进行实验验证前,先进行资料收集,得到如下信息:
物质 | 颜色 | 水中溶解性 |
Fe2S3 | 黑色 | 难溶于水 |
FeS | 黑褐色 | 难溶于水 |
进行如下实验:
实验步骤 | 操作 | 现象 | 备注 |
1 | 向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液 | 产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
2 | 继续滴加3滴0.1 mol/L 硫化钠溶液 | 同上 | |
3 | 继续滴加0.1 mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
(3)写出黑色沉淀转变为黄色沉淀的离子方程式
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤 | 操作 | 现象 |
4 | 向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
5 | 继续滴加3滴0.1 mol/L 氯化铁溶液 | 同上 |
6 | 继续滴加0.1 mol/L 氯化铁溶液至过量 | 同上 |
(4)步骤4与步骤1现象不同的原因可能是
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由
(6)依据以上实验现象,可得出结论:_________________________。
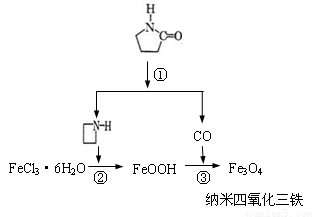
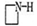 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解