请回答下列问题:
(1)纯水在T ℃时pH=6,该温度下1 mol/L的NaOH溶液中,由水电离出的c(OH-)= mol/L。
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A) pH(B) (填“>”、“=”或“<”);现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) V(B)(填“>”、“=”或“<”)。
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR﹣,HR﹣ R2﹣+H+,若0.1mol•L﹣1NaHR溶液的c(H+)=a mol•L﹣1,则0.1mol•L﹣1H2R溶液中c(H+) (0.1
R2﹣+H+,若0.1mol•L﹣1NaHR溶液的c(H+)=a mol•L﹣1,则0.1mol•L﹣1H2R溶液中c(H+) (0.1 +a) mol•L﹣1(填“<”、“>”或“=”),理由是 。
+a) mol•L﹣1(填“<”、“>”或“=”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH[] | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________。
定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=__________KJ/mol。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式 。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为: (用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为 mL。
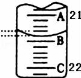
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C= mol/L。
 2NO2(g)和3O2(g)
2NO2(g)和3O2(g)
 2NH3(g)加压、同时移除部分NH3时的速率变化
2NH3(g)加压、同时移除部分NH3时的速率变化 SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。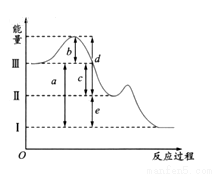
 C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。
C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。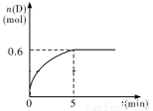
 ol·L-1,则此时该反应______________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
ol·L-1,则此时该反应______________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 mo
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 mo lA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
lA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。 到平衡时, A2的转化率为 。
到平衡时, A2的转化率为 。
