化学物质在生活中有着广泛的应用,下列对应关系错误的是
选项 | 性质 | 应用 |
A | 镁铝合金强度大、质量轻、抗腐蚀能力强 | 制造飞机 |
B | 晶体硅化学性质稳定,能导电 | 制造光纤 |
C | 稀硫酸能与Fe2O3反应 | 除去钢铁表面的铁锈 |
D | NaHCO3受热易分解 | 作焙制糕点的发酵粉 |
某温度下,反应:H2(g) + CO2(g)  H2O(g)+CO(g)的平衡常数K =9/4该温度下,在甲、乙两个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g)+CO(g)的平衡常数K =9/4该温度下,在甲、乙两个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 |
c(H2)/mol • L-1 | 0.010 | 0.020 |
C(CO2)/mol·L-1 | 0.010 | 0.010 |
下列判断正确的是
A.平衡时,甲容器中H2的转化率为60%
B.平衡时,乙容器中H2的转化率大于60%
C.平衡时,乙容器中c(H2)是甲容器中的2倍
D.反应开始时,甲容器中的反应速率比乙容器中的反应速率快
25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH、HClO、 H3PO3溶液中,c(H+)最小的是__________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的电离方程式为___________。Na2HPO3是________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值一定变大的是_______(填字母)。
A.c(H+) B. C.c(CH3COO- ) D.c(CH3COOH)
C.c(CH3COO- ) D.c(CH3COOH)
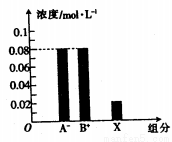
(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_________(填“大于”“小于”或“等于”)醋酸的电离平衡常数。