W、X、Y、Z是短周期元素,其部分性质如下表
W | X | Y | Z |
单质是淡黄色固体 | 与W同周期,其单质常用作半导体材料 | 原子最外层电子数是电子总数的2/3 | 第三周期原子半径最小的金属元素 |
下列说法正确的是( )
A.气态氢化物的热稳定性:X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.简单离子半径:Z>W
D.工业上用Y单质还原Z的氧化物得Z的单质
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol•L-1、0.0010 mol•L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol•L-1)的用量均为4 mL。
(1)写出反应的离子方程式:
(2)请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。
实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究 对反应速率的影响 c. 实验①和④探究催化剂对反应速率的影响。 |
② | 298 | 0.5 | 0.001 | |
③ | 323 | 0.5 | 0.010 | |
④ |
(3)该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由 。
(4)某同学对实验①和②分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次[ | 第3次 | |
① | 12.8 | 13.0 | 11.0 |
② | 4.9 | 5.1 | 5.0 |
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液浓度越小,所需时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。
C、某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验 。
 的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M===NiOOH+MH 下列说法正确的是( )
的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M===NiOOH+MH 下列说法正确的是( ) 增大
增大 减小
减小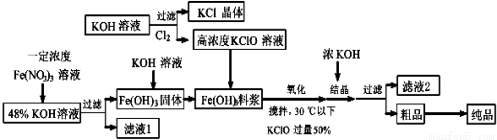
 lO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
lO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
 下列空白:
下列空白: CH3OH(g)。
CH3OH(g)。
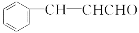 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:


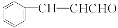 )的分子式为____ __1molF与氢气完全加成,最多消耗氢气___ ___mol
)的分子式为____ __1molF与氢气完全加成,最多消耗氢气___ ___mol