研究SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,用Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO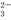 ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:
n(SO | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显____________性,用平衡原理解释:_____________________;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)___________________;
a.c(Na+)=2c(SO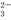 )+c(HSO
)+c(HSO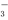 )
)
b.c(Na+)>c(HSO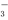 )>c(SO
)>c(SO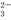 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO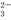 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(2)若某溶液中含3mol Na2SO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和HSO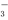 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_____________mol;
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_____________mol;
(3)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为 ,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”);
CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为 ,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”);
(4)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为 。(已知Ksp(BaSO4)=1.1×10-10)
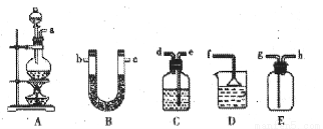
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟上述过程,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化(Co3+的还原产物是Co2+)。
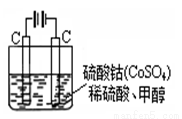
① 写出阳极电极反应式: ;
② 写出除去水中的甲醇的离子方程式: 。
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO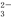 、⑥SO
、⑥SO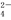 中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用pH试纸检验 | 溶液的pH大于7 |
(2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
(3) | 向(2)所得的水溶液中加入Ba(NO3)2溶液和稀硝酸 | 有白色沉淀产生 |
(4) | 过滤,向滤液中加入AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
下列结论正确的是( )
A. 不能确定的离子是① B. 不能确定的离子是③⑤
C. 肯定含有的离子是①④⑤ D. 肯定没有的离子是②⑤
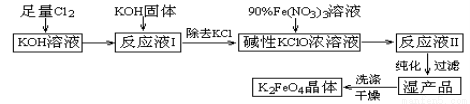
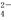 +Cl-+H2O(未配平),下列有关说法不正确的是( )
+Cl-+H2O(未配平),下列有关说法不正确的是( )