甲酸正丁酯是重要的有机原料,可通过酯化反应制得。已知A的核磁共振氢谱吸收峰的高度比为3:2:2:1,丙烯在通常条件下稳定,但遇强氧化剂时容易被氧化生成CO2。
Ⅰ.正丁醇(CH3CH2CH2CH2OH)的制备。
某研究性学习小组为合成正丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 A(液态)
A(液态)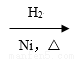 正丁醇;
正丁醇;
(1)已知反应1的原子理论利用率为100%,请写出A的结构简式 。
(2)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号,试剂可以重复使用)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液
③石灰水 ④无水CuSO4 ⑤品红溶液
Ⅱ.甲酸正丁酯的合成。
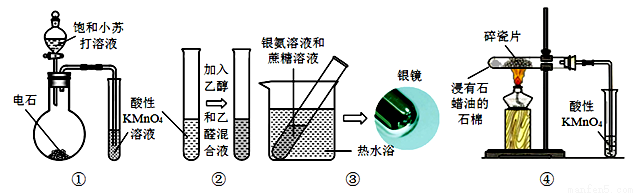
某研究性学习小组利用如图装置进一步合成甲酸正丁酯。

(3)大试管中溶液的作用除了溶解正丁醇外,还有 。
(4)若大试管中溶液是NaOH溶液,则收集到的产物比预期的少,其原因是 。
(5)已知反应结束后烧瓶中是甲酸、正丁醇、甲酸正丁酯和硫酸的混合物,为了回收大量未反应的甲 酸和正丁醇,该研究性小组根据相关理化性质设计以下分离操作步骤流程图。
甲酸 | 正丁醇 | 甲酸正丁酯 | |
熔点/℃ | 8.4 | -88.9 | -91 |
沸点/℃ | 100.8 | 117.7 | 107 |
溶解性 | 三者能相互溶解。 | ||
上述流程图中,操作1是 ,试剂b是 。
碳及其化合物有广泛的用途。
(1)反应C(s)+H2O(g) CO(g)+H2(g)ΔH=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g)ΔH=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g) 2CO(g)△H=+172.5kJ•mol-1
2CO(g)△H=+172.5kJ•mol-1
则反应CO(g)+H2O(g) CO2(g)+H2(g)的△H= kJ•mol-1。
CO2(g)+H2(g)的△H= kJ•mol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)__________v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K= ;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、 “减小”或“不变”)。

 人”,雾霾所形成的气溶胶有丁达尔效应
人”,雾霾所形成的气溶胶有丁达尔效应 浓度说法正确的是( )
浓度说法正确的是( ) )
)
 式为C23H35O7,1mol该物
式为C23H35O7,1mol该物