下列各组物质中,不是按 (“→”表示一步完成)关系相互转化的是
(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
a | HNO3 | CH2=CH2 | NaOH | Fe |
b | NO2 | CH3CH2Br | NaHCO3 | FeCl3 |
c | NO | CH3CH2OH | Na2CO3 | FeCl2 |
反应速率V和反应物浓度的关系是用实验的方法测定的,化学反应:H2+Cl2=2HCl的反应速率V可以表示为:v=k·Cm(H2)·Cn(Cl2),式中的k为常数,m和n的值以可用下列表中数据确定之。
H2(mol/L) | Cl2(mol/L) | V(mol/L·S) |
1.0 | 1.0 | 1.0k |
2.0 | 1.0 | 2.0k |
2.0 | 4.0 | 4.0k |
由此可以推得,m和n的值正确的是
A.m=1,n=2
B.m= 、n=
、n=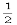
C.m=1,n=
D.m=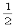 ,n=1
,n=1
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
| 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为5.0mol·L-1
B.根据表中数据计算出混合物中NaHCO3的物质的量分数为50%
C.9.2g混合物中NaHCO3和KHCO3分别为5.0g和4.2g
D.15.7g混合物恰好与盐酸完全反应
A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A.离子键B.极性共价键C.非极性共价键D.氢键
(2)下表为B与F实验的部分内容
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式
写出②中反应的化学方程式
(3).现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO4-需氧化剂的物质的量为mol
(4).化合物D和E相互转化D E,若有D和E·
E,若有D和E· H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E·
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E· H2O的化学式为
H2O的化学式为
碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为,可能发生副反应有。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为。如果理论输出电压为1.50V,能量密度E= 。
(3)向75mL4mol•L-1KOH溶液中缓慢通入4480mLCO2气体(标准状况)恰好完全被吸收。①写出该反应的离子方程式:。
②该吸收溶液中离子浓度大小排序为。
③常温下,amol•L-1KHCO3溶液的pH=8,HCO3?的水解常数约等于。(用含a式表示)。
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=—571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=—566.0kJ•mol-1
③CO(g)+2H2(g) CH3OH(g)△H3=—90.8kJ•mol-1
CH3OH(g)△H3=—90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H= 。
(5)某温度下,发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)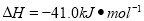
①向某容器中充入1.0molH2和1.0molCO2(g),在一定条件下发生上述反应。混合气体中CO2的物质的量与时间关系如下列所示:
0 | 5min | 10min | 15min | 20min | 25min | |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是,该温度下,平衡常数=。
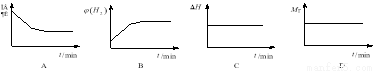
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应。
下列图像正确且说明可逆反应达到平衡状态的是。(填序号)
 中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ng。下列物质中不能满足上述结果的是A.H2和CO的混合气B.C2H2O2C.C3H6O3D.C6H12O5
中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ng。下列物质中不能满足上述结果的是A.H2和CO的混合气B.C2H2O2C.C3H6O3D.C6H12O5 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是 (标况)
(标况)
 离产生的c(H+)大小依次为:A>B>C
离产生的c(H+)大小依次为:A>B>C 验操作和现象是。
验操作和现象是。