18.工业上可用如图装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
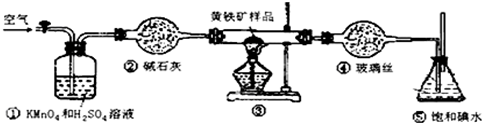
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
则硫铁矿样品中硫元素的质量分数为16.0%(保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.
16.下列实验中所选用的仪器或操作合理的是( )
| A. | 配置1 L0.1 mol/L NaCl 溶液的实验中,用托盘天平称量5.85g氯化钠晶体 | |
| B. | 用湿润pH试纸测定某H2SO4溶液的pH | |
| C. | 可用酸式滴定管量取25.00 mL高锰酸钾溶液 | |
| D. | 用瓷坩埚灼烧碳酸钠晶体 |
15. A、B、C、D、E五种元素,其元素性质或原子结构相关信息如表:
A、B、C、D、E五种元素,其元素性质或原子结构相关信息如表:
(1)A元素在周期表中的位置第3周期第IB副族,写出该单质与浓硝酸反应的化学方程式:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(2)D元素基态原子的价电子轨道表示式为: ;
;
(3)C、D和E三种元素第一电离能由大到小的顺序为F>N>Mg(填元素符号);
(4)C的氢化物的检验方法用湿润的红色石蕊试纸检验,试纸变蓝;
(5)写出B的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O;
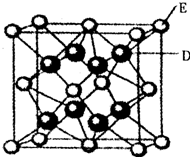
(6)D跟E可形成离子化合物,其晶胞结构如图.该离子化合物晶体的密度为ρ g•cm-3,则晶胞的体积是$\frac{4.12×1{0}^{-22}}{ρ}$cm-3(用含ρ的代数式表示).
 A、B、C、D、E五种元素,其元素性质或原子结构相关信息如表:
A、B、C、D、E五种元素,其元素性质或原子结构相关信息如表:| 元素编号 | 元素性质或原子结构 |
| A | M层全满,N层没有成对电子 |
| B | 第3周期第13列元素 |
| C | 元素的最高价氧化物与它的气态氢化物反应得到离子化合物 |
| D | 基态原子有9种不同的运动状态 |
| E | 基态原子共有4个能级,没有未成对电子 |
(2)D元素基态原子的价电子轨道表示式为:
 ;
;(3)C、D和E三种元素第一电离能由大到小的顺序为F>N>Mg(填元素符号);
(4)C的氢化物的检验方法用湿润的红色石蕊试纸检验,试纸变蓝;
(5)写出B的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O;
(6)D跟E可形成离子化合物,其晶胞结构如图.该离子化合物晶体的密度为ρ g•cm-3,则晶胞的体积是$\frac{4.12×1{0}^{-22}}{ρ}$cm-3(用含ρ的代数式表示).
14.按要求回答下列问题
(1)中国古代四大发明之一--黑火药,它的爆炸反应为中国古代四大发明之一--黑火药,它的爆炸反应为:
2KNO3+3C+S$\frac{\underline{\;引燃\;}}{\;}$A+N2+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为O>N>C>K;
②在生成物中,A的晶体类型为离子晶体;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为1:1;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布为3d84s2.
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与4个氮原子相连,与同一个N原子相连的Al原子构成的空间构型为正四面体.
(4)部分共价键键能数据如表:
根据表中数据推算并写出由氮气和氢气合成氨气的热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-93kJ/mol.
0 173551 173559 173565 173569 173575 173577 173581 173587 173589 173595 173601 173605 173607 173611 173617 173619 173625 173629 173631 173635 173637 173641 173643 173645 173646 173647 173649 173650 173651 173653 173655 173659 173661 173665 173667 173671 173677 173679 173685 173689 173691 173695 173701 173707 173709 173715 173719 173721 173727 173731 173737 173745 203614
(1)中国古代四大发明之一--黑火药,它的爆炸反应为中国古代四大发明之一--黑火药,它的爆炸反应为:
2KNO3+3C+S$\frac{\underline{\;引燃\;}}{\;}$A+N2+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为O>N>C>K;
②在生成物中,A的晶体类型为离子晶体;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为1:1;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布为3d84s2.
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与4个氮原子相连,与同一个N原子相连的Al原子构成的空间构型为正四面体.
(4)部分共价键键能数据如表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
 血红素中含有C、H、O、N、Fe五种元素.回答下列问题:
血红素中含有C、H、O、N、Fe五种元素.回答下列问题: