11.在一容积可变的密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(g)+4H2(g),下列有关叙述正确的是( )
| A. | 增加Fe的量,正反应速率增大 | |
| B. | 将容器的体积缩小一半,正逆反应速率增大 | |
| C. | 保持体积不变,充入Ne,正逆反应速率增大 | |
| D. | 保持压强不变,充入Ne,正逆反应速率不变 |
10.CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
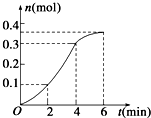

| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
9.根据以下3个热化学方程式:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1=-Q1kJ/mol
2H2S(g)+O2(g)═2S (s)+2H2O(l)△H 2=-Q2 kJ/mol
2H2S(g)+O2(g)═2S (s)+2H2O(g)△H 3=-Q3 kJ/mol
(已知:H2S完全燃烧生成SO2,不完全燃烧生成S)
判断△H1、△H2、△H3三者关系正确的是( )
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1=-Q1kJ/mol
2H2S(g)+O2(g)═2S (s)+2H2O(l)△H 2=-Q2 kJ/mol
2H2S(g)+O2(g)═2S (s)+2H2O(g)△H 3=-Q3 kJ/mol
(已知:H2S完全燃烧生成SO2,不完全燃烧生成S)
判断△H1、△H2、△H3三者关系正确的是( )
| A. | △H1>△H2>△H3 | B. | △H1>△H3>△H2 | C. | △H3>△H2>△H1 | D. | △H2>△H1>△H3 |
8.某溶液中含有HCO3-、SO42-、Na+、SO32-、NO3-、Cl-六种离子.若向其中加入过氧化钠粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
| A. | SO42-、NO3- | B. | NO3-、Cl- | C. | SO32-、NO3- | D. | Cl-、NO3-、Na+ |
7.电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 电解过程中溶液pH不会变化 | |
| C. | 过程中有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
5.一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)?2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.3 mol/(L•min) | |
| B. | 12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的$\frac{1}{5}$ | |
| C. | 若增大X的浓度,则物质Y的转化率减小 | |
| D. | 经12 s达到平衡后,2v(X)=v(Z) |
4.下列说法正确的是( )
0 173373 173381 173387 173391 173397 173399 173403 173409 173411 173417 173423 173427 173429 173433 173439 173441 173447 173451 173453 173457 173459 173463 173465 173467 173468 173469 173471 173472 173473 173475 173477 173481 173483 173487 173489 173493 173499 173501 173507 173511 173513 173517 173523 173529 173531 173537 173541 173543 173549 173553 173559 173567 203614
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 没有物质的变化,就没有能量的变化 | |
| C. | 热化学方程式中,化学式前面的化学计量数只表示物质的量,不表示微粒数 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 |
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察下图,然后回答问题. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.