11.分别向1L 0.5mol•L-1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,下列关系中正确的是( )
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △H1>△H2=△H3 | D. | △H1=△H2<△H3 |
9.下列物质中,与0.3mol H2O含有相同氢原子数的物质是( )
| A. | 18.9 g HNO3 | B. | 3.612×1023个HCl分子 | ||
| C. | 0.1 mol H3PO4 | D. | 4.48 L CH4(标准状况) |
8.2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖.青蒿素分子式C15H22O5,相对分子质量为282.下面关于青蒿素的说法正确的是( )
| A. | 1 mol C15H22O5的质量为282g/mol | |
| B. | C15H22O5的摩尔质量等于它的相对分子质量 | |
| C. | 一个C15H22O5微粒的质量约为 $\frac{282}{6.02×1{0}^{23}}$g | |
| D. | 含有6.02×1023个碳原子的C15H22O5的物质的量为1 mol |
7.下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是:( )
| A. | NH4Cl+NaOH $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+H2O+NH3↑ | |
| B. | Fe+CuSO4═Cu+FeSO4 | |
| C. | CH4+2O2$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2H2O | |
| D. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
6.下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是( )
| 物质 | 杂质(少量) | 试剂和操作方法 | |
| A | O2 | H2O(蒸汽) | 通过浓H2SO4 |
| B | CO2 | CO | 点燃 |
| C | KCl固体 | KClO3 | 加入MnO2并加热 |
| D | KNO3溶液 | Ba(NO3)2溶液 | 加入适量的Na2SO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
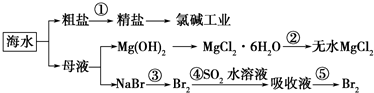
4.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
0 173346 173354 173360 173364 173370 173372 173376 173382 173384 173390 173396 173400 173402 173406 173412 173414 173420 173424 173426 173430 173432 173436 173438 173440 173441 173442 173444 173445 173446 173448 173450 173454 173456 173460 173462 173466 173472 173474 173480 173484 173486 173490 173496 173502 173504 173510 173514 173516 173522 173526 173532 173540 203614

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 从能量转换角度看氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 | |
| D. | 从第③步到第⑤步的目的是为了浓缩富集,提高Br2的浓度 |
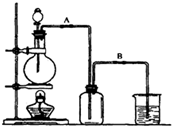 某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图:
某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图: