4.已知下列反应的平衡常数:
H2(g)+S(s)?H2S(g),K1;
S(s)+O2(g)?SO2(g),K2.
则反应:H2(g)+SO2(g)?O2(g)+H2S(g)的平衡常数为( )
H2(g)+S(s)?H2S(g),K1;
S(s)+O2(g)?SO2(g),K2.
则反应:H2(g)+SO2(g)?O2(g)+H2S(g)的平衡常数为( )
| A. | K1+K2 | B. | K-K2 | C. | K1×K2 | D. | $\frac{{K}_{1}}{{K}_{2}}$ |
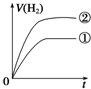
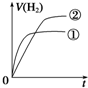
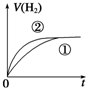
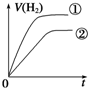
3.化学中常用图象直观地描述化学反应的进程或结果.如图图象描述正确的是( )
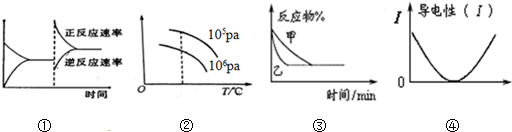

| A. | 图①可表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可表示对“2SO2(g)+O2(g)?2SO2 (g)△H<0”的平衡体系改变T、P后反应物转化率的变化 | |
| C. | 图③可表示使用催化剂对可逆反应C(s)+H2O(g)?CO(g)+H2(g)的影响 | |
| D. | 图④表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 |
2.用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),该反应速率极慢,570K时平衡常数为1×1059.下列说法正确的是( )
| A. | 装有尾气净化装置的汽车排出的气体中一定不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 570K时该反应正向进行的程度很大,故使用催化剂并无实际意义 | |
| D. | 提高尾气净化效率的最佳途径是研制高效催化剂 |
1.工业上制备纯Si反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g)△H=+QkJ/mol (Q>0),下列说法正确的是( )
| A. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| B. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/LNaOH恰好反应 | |
| C. | 达平衡后,减小Si的量,有利于平衡正向移动 | |
| D. | 达平衡后,增大压强,可提高SiCl4的转化率 |
20.下列事实不能用勒夏特列原理解释的是( )
| A. | 氯水中加入NaHCO3固体,溶液颜色变浅 | |
| B. | Fe(SCN)3溶液中加入NaOH固体,血红色变浅 | |
| C. | 双氧水中加入MnO2固体,产生大量气泡 | |
| D. | 浓氨水中加入CaO固体,有刺激性气味气体产生 |
18.下列热化学方程式的书写及相关说法正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-890kJ | |
| B. | 表示H2S气体燃烧热的热化学方程式为:2H2S(g)+O2(g)═2S(s)+2H2O(l)△H=-136kJ/mol | |
| C. | 2mol H2燃烧得水蒸气放热484 kJ,则:H2O(g)═H2(g)+1/2O2(g)△H=+242 kJ/mol | |
| D. | 2NO+O2=2NO2 △H=+116.2kJ/mol |
17.在以下各种情形下,下列电离方程式的书写正确的是( )
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- | |
| B. | H2CO3的电离:H2CO3═2H++CO32- | |
| C. | 水溶液中的NaHCO3电离:NaHCO3═Na++HCO3- | |
| D. | 水溶液中的Fe(OH)3电离:Fe(OH)3═Fe3++3OH- |
16.下列与叙述不正确的是( )
| A. | 水蒸气变为液态水时,焓变△H<0 | |
| B. | 对于△H<0的反应,反应物的总焓大于生成物的总焓 | |
| C. | 需要持续加热才能进行的反应△H一定大于0 | |
| D. | Ba(OH)2•8H2O和NH4Cl固体反应,反应物的总键能小于生成物的总键能 |
15.下列说法正确的是( )
0 173110 173118 173124 173128 173134 173136 173140 173146 173148 173154 173160 173164 173166 173170 173176 173178 173184 173188 173190 173194 173196 173200 173202 173204 173205 173206 173208 173209 173210 173212 173214 173218 173220 173224 173226 173230 173236 173238 173244 173248 173250 173254 173260 173266 173268 173274 173278 173280 173286 173290 173296 173304 203614
| A. | 活化分子一定能发生有效碰撞 | |
| B. | 增大反应物浓度,可以提高活化分子百分数 | |
| C. | 升高温度,可以降低活化能,加快反应速率 | |
| D. | 活化能越小,一般分子就越容易成为活化分子 |