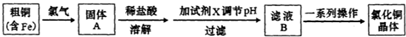5.硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜.
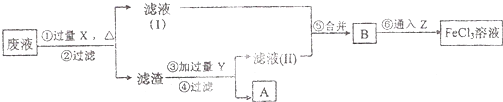
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质).以这种矿石为原料制取硫酸铜的工艺流程如图:
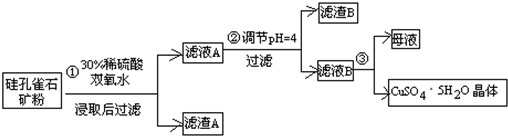
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;
(2)步骤②调节溶液pH选用的最佳试剂是A
A.CuOB.MgO C.FeCO3D NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,不能完全除去的离子是Al3+.
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会伴有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)错误(填“正确”或“错误”).
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
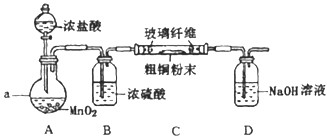
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如图装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
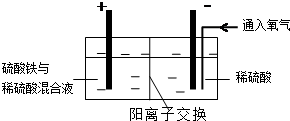
2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S 2Fe3++H2S=2Fe2++S↓+2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+-e-=Fe3+(用电极反应式表示).
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质).以这种矿石为原料制取硫酸铜的工艺流程如图:

请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;
(2)步骤②调节溶液pH选用的最佳试剂是A
A.CuOB.MgO C.FeCO3D NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会伴有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)错误(填“正确”或“错误”).
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如图装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:

2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S 2Fe3++H2S=2Fe2++S↓+2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+-e-=Fe3+(用电极反应式表示).
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).
1.(1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体.
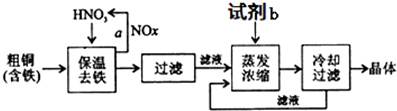
①在步骤a中,还需要通入氧气和水,其目的是将NOx氧化成HNO3;写出化学方程式4NOx+(5-2x)O2+2H2O=4HNO3;
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加人CuO调节溶液的pH.根据下表数据,溶液的pH应保持在3.2≤pH<4.7的范围内;
③进行蒸发浓缩时,加入的试剂b为硝酸溶液,其目的是(结合离子方程式说明)由于Cu2+发生水解Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可抑制Cu2+的水解防止Cu(OH)2的生成.
(2)①某人设想以下图所示装置将NOx转化为硝酸,装置一可用于由N2O4制备N2O5(硝酸的酸酐),装置二用于将NO2转化为硝酸,写出通入NO2的电极的电极反应式:NO2-e-+H2O=NO3-+2H+;电解池阳极反应:N2O4+2HNO3-2e-=2N2O5+2H+.
②若通入NO2的速率为2.24L/min(标准状况),为稳定持续生产,硝酸溶液的浓度应维持质量分数50%不变,则左侧水的流入速率应为7.2mL/min.


①在步骤a中,还需要通入氧气和水,其目的是将NOx氧化成HNO3;写出化学方程式4NOx+(5-2x)O2+2H2O=4HNO3;
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加人CuO调节溶液的pH.根据下表数据,溶液的pH应保持在3.2≤pH<4.7的范围内;
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)①某人设想以下图所示装置将NOx转化为硝酸,装置一可用于由N2O4制备N2O5(硝酸的酸酐),装置二用于将NO2转化为硝酸,写出通入NO2的电极的电极反应式:NO2-e-+H2O=NO3-+2H+;电解池阳极反应:N2O4+2HNO3-2e-=2N2O5+2H+.
②若通入NO2的速率为2.24L/min(标准状况),为稳定持续生产,硝酸溶液的浓度应维持质量分数50%不变,则左侧水的流入速率应为7.2mL/min.

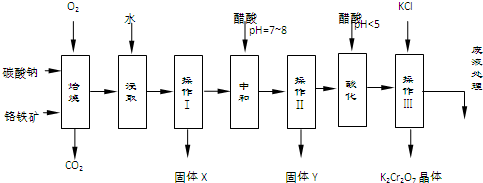
20.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,如图是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)右表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
(5)酸性溶液中过氧化氢能使Cr2O72-生成蓝色的过氧化铬(CrO5分子结构为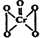 ),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.
),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.
(6)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为94.08%.(保留3位有效数字,K2Cr2O7的摩尔质量为294g/mol).

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)右表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.
),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.(6)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为94.08%.(保留3位有效数字,K2Cr2O7的摩尔质量为294g/mol).
18.实验室用废CuO(含有杂质FeO、Fe2O3)制备胆矾晶体,经历下列过程(Fe3+在pH=5时已完全沉淀):下列分析正确的是( )

0 172846 172854 172860 172864 172870 172872 172876 172882 172884 172890 172896 172900 172902 172906 172912 172914 172920 172924 172926 172930 172932 172936 172938 172940 172941 172942 172944 172945 172946 172948 172950 172954 172956 172960 172962 172966 172972 172974 172980 172984 172986 172990 172996 173002 173004 173010 173014 173016 173022 173026 173032 173040 203614

| A. | 用98%的浓硫酸配制溶解所用的4.5mol•L-1的稀硫酸,只需3种玻璃仪器 | |
| B. | 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量的氯气 | |
| C. | 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、泥三角、三脚架 | |
| D. | 利用Cu(OH)2 替代CuO也可调节溶液pH而不影响实验结果 |