8.有等体积、等pH的Ba(OH)2、NaOH和NH3•H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A. | V3>V2>V1 | B. | V1=V2=V3 | C. | V2>V1=V3 | D. | V1=V2<V3 |
7.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)(填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液完全中和,则消耗的NaOH溶液的体积大小关系为:V(甲)<V(乙)(填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO${\;}_{3}^{-}$ B.CO${\;}_{3}^{2-}$ C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+NaCO2(少量):2CH3COOH+CO32-=H2O+CO2↑+2CH3COO-;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)(填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液完全中和,则消耗的NaOH溶液的体积大小关系为:V(甲)<V(乙)(填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO${\;}_{3}^{-}$ B.CO${\;}_{3}^{2-}$ C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+NaCO2(少量):2CH3COOH+CO32-=H2O+CO2↑+2CH3COO-;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
6.下列各组数据关系中,前者比后者大的是( )
| A. | 100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+数目 | |
| B. | 常温下pH=4的KHSO4溶液和CH3COOK溶液中由水电离出的OH-离子浓度 | |
| C. | 纯水在100℃时的pH和25℃时的pH | |
| D. | 100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+浓度 |
5.室温下,甲、乙两烧杯盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中的描述不正确的是( )
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
4.将浓度为0.1mol•L-1HF溶液加水不断稀释,下列说法正确的是( )
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大、c(HF)减小,则$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$增大 | |
| C. | 稀释过程中,c(OH-)、$\frac{c({H}^{+})}{c(HF)}$均增大 | |
| D. | 溶液的KW、$\frac{c({F}^{-})}{c({H}^{+})}$、pH均不变 |
3.某无色透明的强碱性的溶液中都能大量共存的离子组是( )
| A. | Fe2+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | B. | Mg2+ N${H}_{4}^{+}$ S${O}_{4}^{2-}$ Cl- | ||
| C. | Na+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | D. | Ba2+ Na+ Mn${O}_{4}^{-}$ S${O}_{4}^{2-}$ |
20.在恒温恒压下,向密闭容器中充入4mol A和2mol B,发生如下反应:2A(g)+B(g)?2C(g)△H<0
2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
0 171454 171462 171468 171472 171478 171480 171484 171490 171492 171498 171504 171508 171510 171514 171520 171522 171528 171532 171534 171538 171540 171544 171546 171548 171549 171550 171552 171553 171554 171556 171558 171562 171564 171568 171570 171574 171580 171582 171588 171592 171594 171598 171604 171610 171612 171618 171622 171624 171630 171634 171640 171648 203614
2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
| A. | 若反应开始时容器体积为2 L,则v(C)=0.4mol•L-1•min-1 | |
| B. | 若该反应在恒温恒容下进行,放出热量将增加 | |
| C. | 若2 min后,向容器中再投入等物质的量A、C,则B的转化率不变 | |
| D. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |

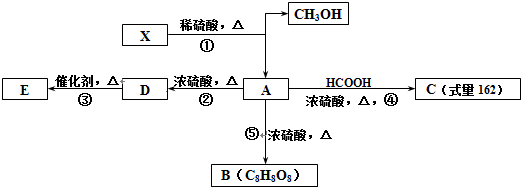
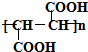
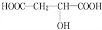 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$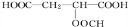 +H2O
+H2O