18.下列离子方程式不正确的是( )
| A. | 将2mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| B. | 向1mol/L明矾溶液50mL中滴入数滴0.1mol/L Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
17.工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
(1)4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
| A. | 反应(1)和(2)均为氧化还原反应 | |
| B. | 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 | |
| C. | 高温下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7时共转移7mol电子 |
16.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H2=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H2=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热△H=-192.9 kJ•mol-1 | |
| B. | 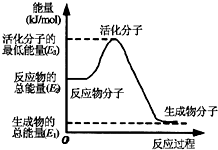 ②中的能量变化如图所示,则△H2=E1-E3 ②中的能量变化如图所示,则△H2=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
15.恒容下的2SO2+O2 ?2SO3;△H<0,达到平衡后,下列可以加快反应速率的方法是( )
| A. | 将SO3分离出一部分 | B. | 升温 | ||
| C. | 充入少量N2,增大压强 | D. | 充入少量SO3气体 |
14.将9g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A. | 原混合物中铜和铁各0.075 mol | |
| B. | 稀硝酸的物质的量浓度为0.5 mol•L-1 | |
| C. | 第一次剩余4.8g金属为铜和铁 | |
| D. | 再加入上述100mL稀硝酸,又得到标准状况下1.12 L NO |
13.短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法错误的是
( )
( )
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
12.下列离子方程式正确的是( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 用惰性电极电解饱和MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
11.X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料,X、Y、Z同周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-. 下列说法正确的是( )
| A. | X和W组成的化合物属于分子晶体 | |
| B. | Y的气态氢化物比Z的气态氢化物稳定 | |
| C. | X的单质既能与NaOH溶液反应,又能与氢氟酸反应 | |
| D. | 向KI-淀粉溶液中通入某气体后变蓝,则该气体一定是Z的单质 |
9.已知一定条件下断裂或生成某些化学键的能量关系如下表:
对于反应:H2+I2=2HI,下列说法正确的是( )
0 170858 170866 170872 170876 170882 170884 170888 170894 170896 170902 170908 170912 170914 170918 170924 170926 170932 170936 170938 170942 170944 170948 170950 170952 170953 170954 170956 170957 170958 170960 170962 170966 170968 170972 170974 170978 170984 170986 170992 170996 170998 171002 171008 171014 171016 171022 171026 171028 171034 171038 171044 171052 203614
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量436kJ |
| 断裂1mol I2分子中的化学键 | 吸收能量151kJ |
| 形成1mol HI分子中的化学键 | 释放能量299kJ |
| A. | 该反应为放热反应 | |
| B. | 该反应中反应物总能量低于生成物总能量 | |
| C. | HI分子中的化学键比H2分子中的化学键更牢固 | |
| D. | 无法判断 |