11.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=-285.8kJ/mol、△H=-890.3kJ/mol、△H=-2800kJ/mol,则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-393.5kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g);△H=+571.6kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3kJ/mol | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l);△H=-1400kJ/mol |
10.下列说法不正确的是( )
| A. | 外界条件改变,化学平衡状态一定发生改变 | |
| B. | 对某一可逆反应,当正、逆反应速率相等时,各组分的浓度一定保持不变 | |
| C. | 甲、乙两个容积相同、温度恒定且相同的密闭容器中,分别充入2molNH3、1mol N2和3molH2,平衡时,甲和乙的N2体积分数相同 | |
| D. | 化学平衡建立前,v正≠v逆,化学平衡后v正=v逆 |
9.下列能用勒沙特列原理解释的是( )
| A. | 在硫酸亚铁溶液中,加入铁粉以防止氧化 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
8.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L的水所含的分子数为0.5NA | |
| B. | 16gS4分子和16gS8分子中所含的硫原子数相等 | |
| C. | 0.1molFe与足量稀硫酸反应失去的电子数为0.3NA | |
| D. | 0.6mol/L的KCl溶液中含有K+个数为0.6NA |
7.已知:Fe3+遇到KSCN溶液显血红色,茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
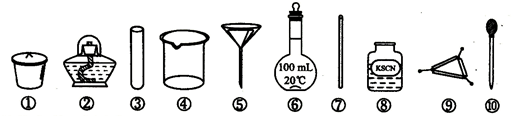

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
6.下列与实验相关的叙述正确的是( )
| A. | Hg(NO3)2溶于水,可将含有Hg(NO3)2的废液倒入水池中,再用水冲入下水道 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,必须冷却至室温才能转移到容量瓶中 | |
| D. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯 |
5.在强碱性的无色溶液中能大量共存的离子组是( )
| A. | K+、Mg2+、MnO4-、Cl- | B. | Na+、Ba2+、NO3-、Cl- | ||
| C. | Na+、H+、SO42-、Cl- | D. | Ca2+、K+、CO32-、NO3- |
2.某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
0 170376 170384 170390 170394 170400 170402 170406 170412 170414 170420 170426 170430 170432 170436 170442 170444 170450 170454 170456 170460 170462 170466 170468 170470 170471 170472 170474 170475 170476 170478 170480 170484 170486 170490 170492 170496 170502 170504 170510 170514 170516 170520 170526 170532 170534 170540 170544 170546 170552 170556 170562 170570 203614
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |